题目内容
【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下:
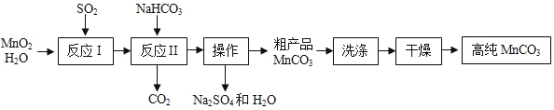
已知:①反应Ⅱ的化学方程式:MnSO4+2NaHCO3=Na2SO4+MnCO3↓+CO2↑+H2O
②MnCO3、Mn(OH)2均难溶于水,MnCO3在100℃时开始分解。
(1)反应Ⅰ的化学方程式为___________,属于基本反应类型中的_____________反应。
(2)流程中“操作”的名称为___________,所需要的主要玻璃仪器有烧杯、玻璃棒、____________。
(3)反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有___________(填化学式)。
(4)验证MnCO3粗产品是否洗净:取最后一次洗涤液,向其中加入适量的____________(填化学式)溶液,无白色沉淀产生,证明已经洗净。
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是____________。
【答案】MnO2+SO2═MnSO4 化合 过滤 漏斗 Mn(OH)2 BaCl2 MnCO3在100℃以上会分解
【解析】
(1)反应Ⅰ的化学方程式为MnO2+SO2═MnSO4,反应由多变一,属于化合反应;
(2)流程中“操作”将难溶性碳酸锰和溶液固液分离,故操作是过滤,过滤还需要用到漏斗;
(3)反应Ⅱ若碱性过强,生成的硫酸锰和碱反应生成难溶性氢氧化锰(Mn(OH)2);
(4)验证MnCO3粗产品是否洗净即检验是否含有硫酸根离子,故加入适量氯化钡(BaCl2)溶液;
(5)获得高纯MnCO3,需选择“低温”干燥的原因是MnCO3在100℃以上会分解。

【题目】K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法错误的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
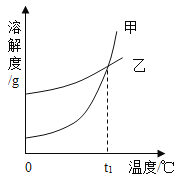
A.t℃在60℃到80℃之间
B.t℃时,两种溶液的溶质质量分数不一定相等
C.将60℃时的210g KNO3饱和液降温至20℃,能析出晶体88.4g
D.两种饱和液从80℃降温到20℃,析出晶体的质量(不含结晶水)无法比较
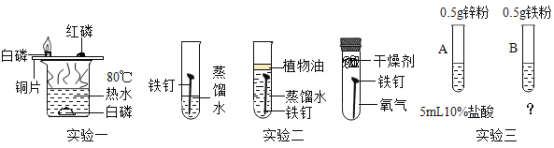
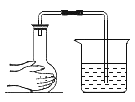
【题目】下列方案设计不能达到实验目的的是( )
选项 | 物质 | 目的 | 主要实验操作 |
A |
| 除杂 | 先通过 |
B |
| 分离 | 溶解、过滤、洗涤、干燥、蒸发 |
C |
| 检验是否变质 | 取样,滴加足量稀盐酸,观察现象 |
D |
| 比较活动性 |
|
A.AB.BC.CD.D
【题目】推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论.请对下列错误观点用化学式或化学方程式写出相应的否定例证.
错误观点 | 否定例证 | |
① | 有单质和化合物生成的反应一定是置换反应 | 举例:CuO+CO |
② | 均一、稳定的液体一定是溶液 | __ |
③ | 含有碳元素的化合物一定是有机物 | __ |
④ | 生成盐和水的反应一定是中和反应 | __ |