题目内容
【题目】如图是加热红色氧化汞粉末得到汞和氧气的反应示意图。据图得出的下列说法中,正确的是( )
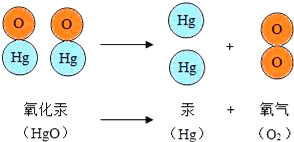
A. 氧化汞分解过程中,原子个数没有发生改变
B. 氧化汞分解过程中,分子的种类没有发生改变
C. 氧化汞分子是该变化中的最小粒子
D. 氧化汞、汞、氧气都是由分子构成
【答案】A
【解析】A.根据质量守恒定律,反应前后原子个数不会改变,结合加热氧化汞微观示意图可知,反应前后汞原子和氧原子个数没有发生改变,故A正确;
B.反应前后,分子的种类一定会改变,加热分解氧化汞,生成了氧气分子和汞原子,故B错误;
C.在化学变化中,分子分裂为原子,原子重新排列组合形成新分子,故原子是化学变化中的最小粒子,故C错误;
D.从微观角度,物质都是由分子或原子构成的,氧化汞和氧气均由分子构成,金属汞是由汞原子构成,故D错误。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目