题目内容
【题目】如图所示是初中化学的一些重要实验,请回答:
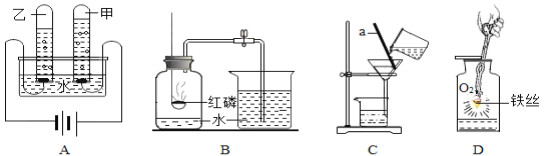
(1)实验A:通电后,乙中产生的是______;
(2)实验 B:测得空气中氧气体积分数小于1/5的原因可能是(只答一条):______;
(3)实验C:实验过程中我们发现过滤速度很慢,可能的原因是:_____________;
(4)实验D:写出铁丝燃烧的符号表达式:_______,反应类型是_______。
【答案】氢气 装置的气密性不好(合理即可) 滤纸未紧贴漏斗内壁 Fe+O2 ![]() Fe3O4 化合
Fe3O4 化合
【解析】
(1)水通电时,正极产生氧气,负极产生氢气,氧气和氢气的体积比为1:2,故通电后,乙中产生的是氢气;
(2)测得空气中氧气体积分数小于1/5的原因可能是装置的气密性不好、红磷量不足、没有冷却至室温就打开弹簧夹等;
(3)实验过程中我们发现过滤速度很慢,可能的原因是滤纸未紧贴漏斗内壁;
(4)铁在氧气中燃烧生成四氧化三铁,反应的符号表达式Fe+O2 ![]() Fe3O4;该反应符合多变一的特征,属于化合反应。
Fe3O4;该反应符合多变一的特征,属于化合反应。

练习册系列答案
相关题目