题目内容
【题目】实验室中的试剂一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组发现一瓶未密闭的KOH固体,对其成分提出以下假设,并完成了实验探究.
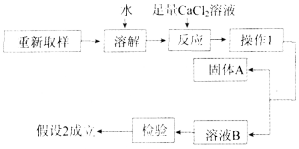
假设1:只含KOH;假设2:含KOH和K2CO3;假设3:只含K2CO3.
(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________.
(2)取少量样品于试管中,加入足量稀盐酸,观察到________________________,说明假设2或假设3成立.
(3)进一步探究的过程如下:
①“操作1”的名称是________.
②“固体A”的化学式是________.
③加入足量CaCl2溶液的作用是________________________________________________
________________________________________________________________________.
(4)变质试剂也有利用价值,从KOH和K2CO3的组成和性质看,这瓶变质试剂的用途是____________________________________________________________________(写出一条).
【答案】(1)2KOH+CO2=K2CO3+H2O
(2)有气泡产生
(3)①过滤 ②CaCO3 ③将碳酸钾完全反应,防止其干扰接下来的实验
(4)作钾肥(其他答案合理均可)
【解析】(1)KOH在空气中变质的原因是与CO2发生反应,CO2+2KOH=K2CO3+H2O.(2)假设2或假设3成立,说明样品中有K2CO3,加入足量稀盐酸会产生CO2气体,因此,现象是有气泡产生.(3)将样品溶于水加足量CaCl2溶液,发生反应CaCl2+K2CO3=CaCO3↓+2KCl,因此,操作1是过滤,固体A是CaCO3,溶液B中一定有KCl,可能有KOH,向溶液B中加入酚酞溶液的目的是检验溶液B中是否含有KOH,由于K2CO3溶液也显碱性,因此,为防止对KOH检验的干扰,开始应加入足量的CaCl2溶液以除去K2CO3.(4)KOH变质后生成的K2CO3可作钾肥.

 黄冈天天练口算题卡系列答案
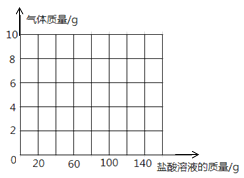
黄冈天天练口算题卡系列答案【题目】(7分)为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:
实验 | 1 | 2 | 3 | 4 | 5 |
样品质量/g | 13 | 13 | 13 | 13 | 13 |
加入盐酸质量/g | 15 | 30 | 80 | 130 | 150 |
反应后物质质量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |
(1)13g样品完全反应时放出气体的质量是 g。
(2)纯碱样品中Na2CO3的质量分数是多少?(写出计算过程,结果保留小数点后一位)
(3)13g样品与盐酸恰好完全反应后生成物溶液中溶质的质量分数是 (只写结果,保留小数点后一位)。
(4)若向13g样品中持续不断的加入稀盐酸,请你画出加入稀盐酸与生成气体的质量关系图。(在答题卡的坐标中作图)