题目内容
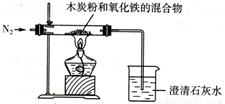
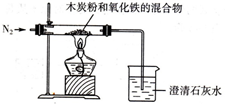
已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C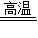 4Fe+CO2↑,某同学设计了一个实验,证明氧化铁中含有氧元素,并测定氧化铁中氧元素的质量分数,实验装置如图.
4Fe+CO2↑,某同学设计了一个实验,证明氧化铁中含有氧元素,并测定氧化铁中氧元素的质量分数,实验装置如图.(1)实验前,首先要进行的操作是 .
(2)实验中,盛放澄清石灰水的烧杯中出现的现象是 ,原因是 .
(3)实验中通入的气体是纯净干燥的N2,写出不用空气的理由:
① ;
② ;
也不能用潮湿的氮气,原因是 .
(4)如用3.2g氧化铁与碳充分反应,测得澄清石灰水增重1.32g,则氧化铁中氧元素的质量分数为 .
【答案】分析:(1)本题的要求要从实验目的考虑;
(2)欲正确解答本题,须知二氧化碳和石灰水反应的情况,以及生成物的性质;
(3)本题需从实验的要求和注意事项方面考虑;
(4)石灰水增加的质量即为生成的CO2的质量,由方程式3C+2Fe2O3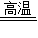 4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,根据元素的质量分数公式计算即可.
4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,根据元素的质量分数公式计算即可.
解答:解:(1)空气中的氧气能够和碳发生反应生成二氧化碳等物质,为了防止干扰实验结论,所应该通入氮气,赶尽管内空气,然后在加热.
(2)因为木炭粉和氧化铁反应后生成的二氧化碳气体通入澄清石灰水的烧杯中,和石灰水发生反应,生成碳酸钙沉淀,所以可以观察到澄清的石灰水变浑浊.
(3)因为空气中含有二氧化碳和氧气,可能使反应物和生成物的质量增加而导致实验结果不准确.
实验中也不能用潮湿的氮气的原因是:用潮湿的氮气会使热的试管炸裂,同时在高温下水也能和碳反应,导致木炭不仅和氧化铁反应,会导致测定的氧元素的质量分数偏大.
(4)石灰水增加的质量即为生成的CO2的质量,由方程式3C+2Fe2O3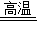 4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,CO2中氧元素的质量为1.32g×
4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,CO2中氧元素的质量为1.32g×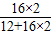 ×100%=0.96g,故氧化铁中氧元素的质量分数为:
×100%=0.96g,故氧化铁中氧元素的质量分数为: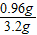 ×100%=30%.
×100%=30%.
故答案为:(1)先通氮气赶走装置中残余的空气;
(2)澄清石灰水变浑浊;反应生成了大量的二氧化碳;
(3)①混有氧气.若碰到可燃性气体会发生爆炸,有危险;
②空气中含有很多含氧元素的物质,这样会干扰对氧化铁中氧元素含量的判断;影响氧化铁中氧元素含量的测定;
(4)30%.
点评:本题主要考查学生对实验操作的要求和注意事项的掌握情况以及运用元素的质量分数公式进行计算的能力.
(2)欲正确解答本题,须知二氧化碳和石灰水反应的情况,以及生成物的性质;
(3)本题需从实验的要求和注意事项方面考虑;
(4)石灰水增加的质量即为生成的CO2的质量,由方程式3C+2Fe2O3
 4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,根据元素的质量分数公式计算即可.
4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,根据元素的质量分数公式计算即可.解答:解:(1)空气中的氧气能够和碳发生反应生成二氧化碳等物质,为了防止干扰实验结论,所应该通入氮气,赶尽管内空气,然后在加热.
(2)因为木炭粉和氧化铁反应后生成的二氧化碳气体通入澄清石灰水的烧杯中,和石灰水发生反应,生成碳酸钙沉淀,所以可以观察到澄清的石灰水变浑浊.
(3)因为空气中含有二氧化碳和氧气,可能使反应物和生成物的质量增加而导致实验结果不准确.
实验中也不能用潮湿的氮气的原因是:用潮湿的氮气会使热的试管炸裂,同时在高温下水也能和碳反应,导致木炭不仅和氧化铁反应,会导致测定的氧元素的质量分数偏大.
(4)石灰水增加的质量即为生成的CO2的质量,由方程式3C+2Fe2O3
 4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,CO2中氧元素的质量为1.32g×
4Fe+3CO2↑可知,氧化铁中氧元素的质量即为生成的CO2中氧元素的质量,CO2中氧元素的质量为1.32g×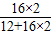 ×100%=0.96g,故氧化铁中氧元素的质量分数为:
×100%=0.96g,故氧化铁中氧元素的质量分数为: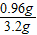 ×100%=30%.
×100%=30%.故答案为:(1)先通氮气赶走装置中残余的空气;
(2)澄清石灰水变浑浊;反应生成了大量的二氧化碳;
(3)①混有氧气.若碰到可燃性气体会发生爆炸,有危险;
②空气中含有很多含氧元素的物质,这样会干扰对氧化铁中氧元素含量的判断;影响氧化铁中氧元素含量的测定;
(4)30%.
点评:本题主要考查学生对实验操作的要求和注意事项的掌握情况以及运用元素的质量分数公式进行计算的能力.

练习册系列答案
相关题目
 已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C
已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C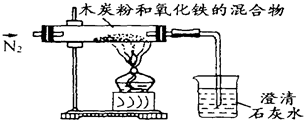 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C 已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C
已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C 4Fe+CO2↑,某同学设计了一个实验,证明氧化铁中含有氧元素,并测定氧化铁中氧元素的质量分数,实验装置如图.
4Fe+CO2↑,某同学设计了一个实验,证明氧化铁中含有氧元素,并测定氧化铁中氧元素的质量分数,实验装置如图. 4Fe+3CO2↑或者为:Fe2O3+3C
4Fe+3CO2↑或者为:Fe2O3+3C 2Fe+3CO↑
2Fe+3CO↑ 4FeO十CO2↑,为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入碳多少克? .
4FeO十CO2↑,为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入碳多少克? .