题目内容
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C 4Fe+3CO2↑或者为:Fe2O3+3C
4Fe+3CO2↑或者为:Fe2O3+3C 2Fe+3CO↑
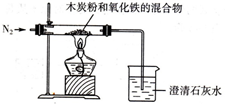
2Fe+3CO↑某同学设计一个实验,假定恰好完全反应,测定此反应中的气体生成物,实验装置如图.
(1)实验中通入的气体是纯净干燥的N2,写出不用空气的主要理由 ,实验也不能用潮湿的氮气,原因是 .
(2)如用氧化铁与木炭粉的混合物3.8g反应,充分反应后测得固体质量减轻1.56g,则生成的气体为 .
(3)烧杯内适量澄清石灰水的现象为 ,若氧化铁的质量与本次实验相同,要使澄清石灰水的现象也与本次实验相同,则固体混合物总质量(m)的取值范围应该是 .
(4)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3.
①当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 .
②以Fe2O3为原料制备上述催化剂,可向其中加入适量碳,发生如下反应:2Fe2O3+C
 4FeO十CO2↑,为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入碳多少克? .
4FeO十CO2↑,为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入碳多少克? .
【答案】分析:(1)从空气和潮湿的氮气引入的杂质分析,从而产生对实验的影响;
(2)利用假设法:①若减少的质量1.56g完全转化成二氧化碳,计算出分别需要氧化铁和碳的质量,并与3.8g对照是否符合;②若减少的质量1.56g完全转化成一氧化碳,计算出分别需要氧化铁和碳的质量,并与3.8g对照是否符合,得出结论;
(3)根据生成的气体是一氧化碳还是二氧化碳确定石灰水是否变浑浊;若不产生二氧化碳,则固体混合物的质量应大于保证生成一氧化碳的最低值,应小于生成二氧化碳的最低值;
(4)①根据该混合物中FeO与Fe2O3的质量比,由两氧化物中铁元素的质量分数,可求得混合物与所含铁的质量关系,即可得此时铁的氧化物混合物中铁的质量分数;
②分析题意可知当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高,所以可根据反应结束后生成的FeO的质量和剩余Fe2O3的质量之比为9:20建立等式.
所以解题思路就是设出木炭的质量,根据化学方程式求出生成的FeO的质量和剩余的Fe2O3质量即可解答.
解答:解:(1)①因为空气中含有二氧化碳和水,将使测定的结果不准确,故不能用空气代替干燥的氮气;②因为潮湿的氮气中含有水分,也将使得测定的结果不准确,故不能用潮湿的氮气代替干燥的氮气;
(2)①若减少的质量1.56g完全转化成二氧化碳,设需要氧化铁的质量为x,需要碳的质量为y
2Fe2O3+3C 4Fe+3CO2↑
4Fe+3CO2↑
320 36 132
x y 1.56g
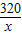 =
= x=3.78g
x=3.78g
 =
= y=0.42g
y=0.42g
∵3.78g+0.42g=4.2g>3.8g∴该气体不是二氧化碳;
②若减少的质量1.56g完全转化成一氧化碳,设需要氧化铁的质量为x,需要碳的质量为y
Fe2O3+3C 2Fe+3CO↑
2Fe+3CO↑
160 36 84
x y 1.56g
 =
=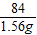 x=2.97g
x=2.97g
 =
= y=0.66g
y=0.66g
∵2.97g+0.66g=3.63g<3.8g,,成立,故生成的气体是一氧化碳;
(3)①因为产生的气体是一氧化碳,故不能使石灰水变浑浊;
②若不产生二氧化碳,则固体混合物的质量最低值是二者恰好反应,保证产生一氧化碳,是3.63g;
固体混合物的质量最高值是小于二者恰好完全反应产生二氧化碳的最少量,是4.2g,
故固体混合物的取值范围是大于3.63g而小于4.2g;
(4)①假设此时混合物中FeO的质量为9m,则Fe2O3的质量为20m,混合物的质量为29m
混合物中铁的质量分数=9m× ×100%+20m×
×100%+20m× ×100% 29m=72%
×100% 29m=72%
②设反应生成FeO的质量为x,消耗Fe2O3的质量为y,需要加入碳的质量为z
2Fe2O3+C 4FeO+CO2↑
4FeO+CO2↑
320 12 288
y z x
 =
= y=
y=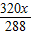
 =
= z=
z=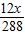
则活性最高的催化剂中FeO与Fe2O3的质量之比=x:(480g- )=9:20,解得x=144g
)=9:20,解得x=144g
应加入碳的质量= =6g
=6g
答:(1)此时铁的氧化物混合物中铁的质量分数为72%;
(2)为制得这种活性最高的催化剂,应向480gFe2O3粉末中加入碳6g.
故答案为:(1)空气中含有二氧化碳和水,将使测定的结果不准确;潮湿的氮气中含有水分,也将使得测定的结果不准确;
(2)CO;(3)澄清石灰水无变化; 大于3.63g而小于4.2g (4)①72% 6g.
点评:本题难度较大,主要考查学生根据定量法计算气体的成分和根据化学方程式进行计算的能力,对于本题主要是要分析题意,找出建立等式的依据即可解答.
(2)利用假设法:①若减少的质量1.56g完全转化成二氧化碳,计算出分别需要氧化铁和碳的质量,并与3.8g对照是否符合;②若减少的质量1.56g完全转化成一氧化碳,计算出分别需要氧化铁和碳的质量,并与3.8g对照是否符合,得出结论;
(3)根据生成的气体是一氧化碳还是二氧化碳确定石灰水是否变浑浊;若不产生二氧化碳,则固体混合物的质量应大于保证生成一氧化碳的最低值,应小于生成二氧化碳的最低值;
(4)①根据该混合物中FeO与Fe2O3的质量比,由两氧化物中铁元素的质量分数,可求得混合物与所含铁的质量关系,即可得此时铁的氧化物混合物中铁的质量分数;
②分析题意可知当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高,所以可根据反应结束后生成的FeO的质量和剩余Fe2O3的质量之比为9:20建立等式.
所以解题思路就是设出木炭的质量,根据化学方程式求出生成的FeO的质量和剩余的Fe2O3质量即可解答.
解答:解:(1)①因为空气中含有二氧化碳和水,将使测定的结果不准确,故不能用空气代替干燥的氮气;②因为潮湿的氮气中含有水分,也将使得测定的结果不准确,故不能用潮湿的氮气代替干燥的氮气;
(2)①若减少的质量1.56g完全转化成二氧化碳,设需要氧化铁的质量为x,需要碳的质量为y
2Fe2O3+3C
 4Fe+3CO2↑
4Fe+3CO2↑320 36 132
x y 1.56g
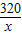 =
= x=3.78g
x=3.78g =
= y=0.42g
y=0.42g∵3.78g+0.42g=4.2g>3.8g∴该气体不是二氧化碳;
②若减少的质量1.56g完全转化成一氧化碳,设需要氧化铁的质量为x,需要碳的质量为y
Fe2O3+3C
 2Fe+3CO↑
2Fe+3CO↑160 36 84
x y 1.56g
 =
=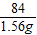 x=2.97g
x=2.97g =
= y=0.66g
y=0.66g∵2.97g+0.66g=3.63g<3.8g,,成立,故生成的气体是一氧化碳;
(3)①因为产生的气体是一氧化碳,故不能使石灰水变浑浊;
②若不产生二氧化碳,则固体混合物的质量最低值是二者恰好反应,保证产生一氧化碳,是3.63g;
固体混合物的质量最高值是小于二者恰好完全反应产生二氧化碳的最少量,是4.2g,
故固体混合物的取值范围是大于3.63g而小于4.2g;
(4)①假设此时混合物中FeO的质量为9m,则Fe2O3的质量为20m,混合物的质量为29m
混合物中铁的质量分数=9m×
 ×100%+20m×
×100%+20m× ×100% 29m=72%
×100% 29m=72%②设反应生成FeO的质量为x,消耗Fe2O3的质量为y,需要加入碳的质量为z
2Fe2O3+C
 4FeO+CO2↑
4FeO+CO2↑320 12 288
y z x
 =
= y=
y=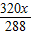
 =
= z=
z=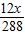
则活性最高的催化剂中FeO与Fe2O3的质量之比=x:(480g-
 )=9:20,解得x=144g
)=9:20,解得x=144g应加入碳的质量=
 =6g
=6g答:(1)此时铁的氧化物混合物中铁的质量分数为72%;
(2)为制得这种活性最高的催化剂,应向480gFe2O3粉末中加入碳6g.
故答案为:(1)空气中含有二氧化碳和水,将使测定的结果不准确;潮湿的氮气中含有水分,也将使得测定的结果不准确;
(2)CO;(3)澄清石灰水无变化; 大于3.63g而小于4.2g (4)①72% 6g.
点评:本题难度较大,主要考查学生根据定量法计算气体的成分和根据化学方程式进行计算的能力,对于本题主要是要分析题意,找出建立等式的依据即可解答.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
 已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C
已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C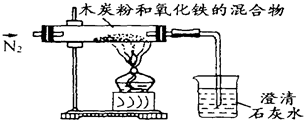 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C 4Fe+3CO2↑或者为:Fe2O3+3C
4Fe+3CO2↑或者为:Fe2O3+3C 已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C
已知木炭粉和Fe2O3反应的化学方程式:2Fe2O3+3C