题目内容
【题目】分析处理图表中的信息是学习化学的一种重要方法.
(1)下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
①40℃时,氯化钠的溶解度为 g.
②碳酸钠的溶解度随温度的升高而(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是 (填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为 (计算结果精确到0.1%).
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式 . 如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是 (填标号).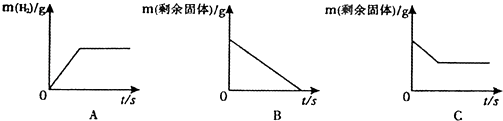
【答案】
(1)36.6,增大,饱和溶液,23.1%
(2)Fe+2HCl=FeCl2+H2↑,A C
【解析】(1)①从表中查出该温度下的溶解度即可,所以40℃时,氯化钠的溶解度为36.6g;②根据表格中数据可知碳酸钠溶解度随温度的升高而增大;20℃时,碳酸钠的溶解度是21.8g,所以在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是饱和溶液,只溶解了21.8g,在30℃时,碳酸钠的溶解度是39.7g,所以20℃时,将100g的水加入30g碳酸钠中,再升温到30℃,该溶液的溶质质量分数为:30g/130g×100%=23.1%;
(2)铁与盐酸反应生成氯化亚铁和氢气,根据铁与盐酸没反应前,没有氢气,所以随着反应的进行,氢气的质量在不断增加,反应结束,氢气质量不再增加,所以A正确;铁与盐酸反应后,变为液体,所以固体质量在不断减少,由于铜与盐酸不反应,所以最后剩余固体质量不能为零,所以C正确.
所以答案是:(1)36.6; ②增大; 饱和溶液; 23.1%;(2)Fe+2HCl=FeCl2+H2↑; A C.
【考点精析】掌握固体溶解度的影响因素和溶质的质量分数是解答本题的根本,需要知道影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度:大多数固体物的溶解度随温度升高而升高;如KNO3;少数固体物质的溶解度受温度的影响很小;如NaCl;极少数物质溶解度随温度升高而降低.如Ca(OH)2;溶质的质量分数=(溶质质量/溶液质量)*100% = [溶质质量/(溶质质量+溶剂质量]*100%.