题目内容
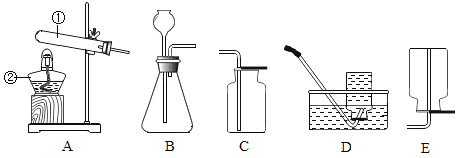
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记.②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.③充分反应后,待集气瓶冷却至室温,打开止水夹。请回答下列问题:
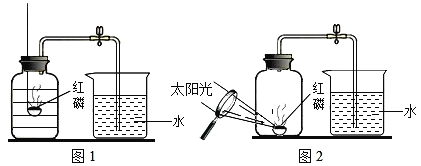
(1)该实验中红磷需稍过量,目的是___________。
(2)步骤②集气瓶中的现象是________,其反应的文字表达式为________;步骤③中打开止水夹后观察到的现象是_________,由此可得出空气中氧气的体积分数约为_____。
(3)小洁通过该实验测得的空气中氧气的体积分数与正常值相比偏小,其原因可能是_____
A 燃烧匙内可燃物量不足
B 装置气密性不好
C 未及时塞进橡胶塞
D 燃烧匙内可燃物有剩余
(4)该实验可推论出氮气_______(填“易”或“难”)溶于水和其化学性质_________(填“活泼”或“不活泼”)的结论.
(5)若将红磷换成炭粉,该实验能否获得成功?为什么?_____成功,原因是______。
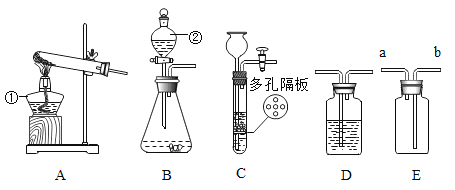
(6)小华同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是:_________。
【答案】将集气瓶中的氧气尽可能的消耗完全,使实验结果更准确 产生大量的白烟,放出热量 ![]() 烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一
烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一 ![]() AB 难 不活泼 不能 炭粉在氧气中点燃生成二氧化碳,补充了消耗的氧气的量,不能形成压强差 避免了因红磷燃烧导致集气瓶内的空气受热膨胀逸出而引起误差
AB 难 不活泼 不能 炭粉在氧气中点燃生成二氧化碳,补充了消耗的氧气的量,不能形成压强差 避免了因红磷燃烧导致集气瓶内的空气受热膨胀逸出而引起误差
【解析】
磷在氧气中点燃生成五氧化二磷,碳在氧气中点燃生成二氧化碳。
(1)过量的红磷能够将集气瓶中的氧气尽可能的消耗完全,故该实验中红磷需稍过量,目的是将集气瓶中的氧气尽可能的消耗完全,使实验结果更准确。
(2)步骤②是红磷在氧气中燃烧,故集气瓶中的现象是产生大量的白烟,放出热量,其反应的文字表达式为![]() ;步骤③中打开止水夹后观察到的现象是烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一,消耗的氧气体积等于进入集气瓶中水的体积,可得出空气中氧气的体积分数约为
;步骤③中打开止水夹后观察到的现象是烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一,消耗的氧气体积等于进入集气瓶中水的体积,可得出空气中氧气的体积分数约为![]() 。
。
(3)测得的空气中氧气的体积分数与正常值相比偏小,其原因可能是装置气密性不好,燃烧匙内可燃物量不足,故选AB。
(4)在该实验中,剩余的气体主要是氮气,说明氮气不能燃烧,也不能支持燃烧,故实验可推论出氮气难溶于水和其化学性质不活泼的结论。
(5)碳在氧气中点燃生成二氧化碳,若将红磷换成炭粉,该实验不能获得成功,原因是炭粉在氧气中点燃生成二氧化碳,补充了消耗的氧气的量,不能形成压强差。
(6)改进后的优点是:避免了因红磷燃烧导致集气瓶内的空气受热膨胀逸出而引起误差。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】如图是两种原子的原子结构示意图:
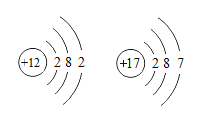
(1)写出它们能形成单质的化学式______、______;
(2)写出它们能形成化合物的化学式______:
(3)写出它们能形成的阳离子的化学符号______。
【题目】工业上用电解饱和食盐水的方法来制取氢氧化钠等化学物质。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
NaOH | 42 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | 314 | 329 | 347 | |
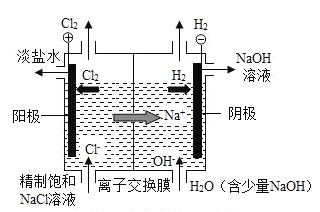
(1)离子交换电解槽中阴极部分得到的产品是 NaOH 和_____。
(2)在电解槽的阳极部分,饱和食盐水变成淡盐水的原因是_____减少(填“溶质”或“溶剂”)。除去淡盐水中的溶解的少量 Cl2,有关反应的化学方程式是Na2SO3+Cl2+H2O=Na2SO4+2X.其中 X 的化学式是_____。
(3)20℃时,50g 水中最多溶解 NaOH 的质量是_____g。
(4)从含有少量 NaCl 杂质的 NaOH 固体中获取纯净 NaOH 固体的方法是:溶解→_____结晶→_____→洗涤→干燥。