题目内容
【题目】按要求填写下列空白。
(1)请用相应的化学用语填空:
①1个氧分子_____
②钙元素_____
③5个硫酸根离子_____
④标出氧化铝中铝元素的化合价_____
⑤氯化钠是由_____和_____两种微粒构成的
(2)指出下列化学符号中数字“2”的意义:
①2H_____
②CO2_____
③Mg2+_____
④![]() :_____
:_____
【答案】O2 Ca 5SO42- ![]() Na+ Cl- 2个氢原子 一个CO2分子中含有2个氧原子 一个Mg2+带2个单位的正电荷 水中氧元素的化合价为-2
Na+ Cl- 2个氢原子 一个CO2分子中含有2个氧原子 一个Mg2+带2个单位的正电荷 水中氧元素的化合价为-2
【解析】
(1)①氧分子是双原子分子,1个氧分子:O2
②钙元素:Ca
③离子符号前面的数字表示离子个数,5个硫酸根离子:5SO42-
④氧化铝中氧元素-2价,铝元素+3价,标出氧化铝中铝元素的化合价:![]()
⑤氯化钠是离子化合物,由Na+和Cl-两种微粒构成的
(2)①2H表示2个氢原子;
②CO2表示一个二氧化碳分子中含有2个氧原子;
③Mg2+表示一个镁离子带2个单位正电荷;
④![]() :表示水中氧元素化合价为+2价;
:表示水中氧元素化合价为+2价;

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如下,请计算:
实验次数 | 1 | 2 | 3 | 4 |
稀盐酸的累计加入量/g | 40.0 | 80.0 | 120.0 | 160.0 |
产生CO2的总质量/g | 2.2 | m | 5.5 | 5.5 |
(1)m=_____;
(2)15g大理石样品与稀盐酸反应最多产生二氧化碳的质量是_____g;
(3)15g石灰石样品与盐酸恰好完全反应时,消耗的盐酸质量为_____g;
(4)在下图中画出生成气体的质量与加入稀盐酸的质量的关系_____。
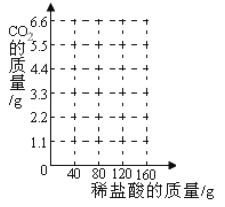
(5)石灰石样品中碳酸钙的质量分数是多少?_____(写出计算过程,结果保留一位小数)
【题目】同学们从山上采集到一种石灰石,他们取80克该样品进行锻烧实验(所含杂质在锻烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)CaCO3由_____种元素组成,其中钙元素的质量分数为_____
(2)当石灰石完全反应后,生成CO2的质量为_____g
(3)求该石灰石中CaCO3的质量分数,写出计算过程。______
(4)请在下面坐标图中,画出锻烧时生成气体的质量(m)随时间( t )变化的曲线。____________
【题目】某化学兴趣小组同学发现,除二氧化锰外其他物质也能作氯酸钾分解的催化剂,那么氧化铜是否能作氯酸钾分解的催化剂?于是进行了如下的探究。
提出问题:氧化铜是否能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
设计实验:同学们设计了下面三组实验,实验中“待测数据”是生成相同体积的氧气所需时间(其它可能影响实验的因素均忽略)。
实验编号 | 氯酸钾 | 其它物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | 二氧化锰0.5g | |
③ | xg | 氧化铜0.5g |
问题讨论:
(1)实验②中反应的文字表达式是_____,实验③中x的数值为_____。
(2)由实验③与实验_____的“待测数据”相对比,若实验③“待测数据”更_____(填“大”或“小”),则说明氧化铜能加快氯酸钾的分解速率。
反思提升:
(1)若要证明氧化铜是该反应的催化剂,还要设计实验验证它在化学反应前后的_____和_____不变。
(2)你认为同学们设计实验②和实验③的对比的目的是_____。