题目内容
【题目】某同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
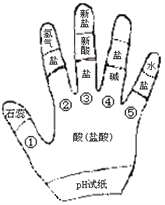
(1)如用湿润的pH试纸测定氢氧化钠的pH,则结果会_______(填“偏大”、“偏小”、“无影响”)。
(2)图中性质②与盐酸反应的物质是_________(举一例)。
(3)写出一个符合图中③的方程式________________________。
(4)图中性质④反应的实质是酸溶液中的氢离子与碱溶液中的________(填微粒符号)生成水分子。
【答案】 偏小 锌(Zn) (合理即可) HCl+AgNO3=AgCl↓+HNO3(合理即可) OH-
【解析】本题主要考查酸碱的化学性质,可根据酸碱的化学性质解答。
用湿润的pH试纸测定氢氧化钠的pH。相当将氢氧化钠溶液稀释,碱性变弱,pH变小。故填:偏小。
图中性质②与盐酸反应生成的是氢气和盐。能与酸反应生成氢气的是金属。故填:锌
(3)图中③是盐与酸反应生成新盐和新酸。故可写盐酸与硝酸银的反应。化学方程式为:HCl+AgNO3=AgCl↓+HNO3
(4)图中性质④是碱与酸反应生成水和盐。根据复分解反应的条件可知是氢离子与氢氧根离子结合生成水。故填:OH-

练习册系列答案
相关题目