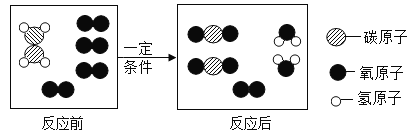
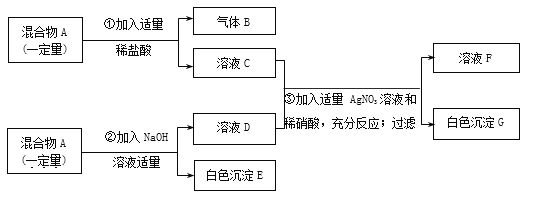
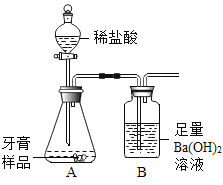
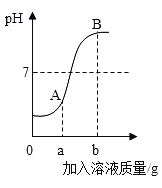
题目内容
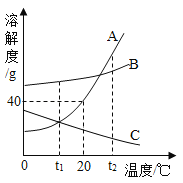
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
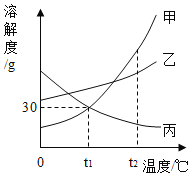
(1)气体的溶解度随温度变化情况与________(选填“甲”“乙”或“丙”)相似。
(2)若乙中混有少量的甲,最好采用________的方法提纯乙。
(3)t1℃时,向盛有15g丙物质的烧杯中加入50 g水,充分溶解后得到65 g溶液。若要增大该溶液的溶质质量分数,可采用的方法是___________。
【答案】丙 蒸发结晶 降低温度并增加溶质丙
【解析】
(1)气体物质的溶解度随温度的升高而减小,所以气体的溶解度随温度变化情况与丙相似;
(2)乙物质的溶解度受温度变化影响较小,所以若乙中混有少量的甲,最好采用蒸发结晶的方法提纯乙;
(3)丙物质的溶解度随温度的升高而减小,t1℃时,丙物质的溶解度是30g,所以向盛有15g丙物质的烧杯中加入50g水,充分溶解后得到65g溶液。若要增大该溶液的溶质质量分数,可采用的方法是:降低温度并增加溶质丙。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目