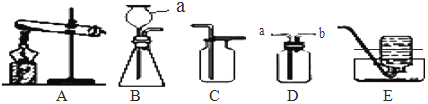题目内容
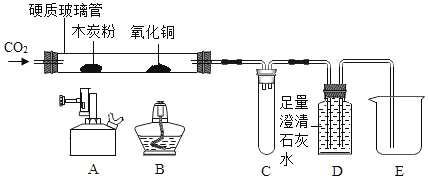
【题目】化学学习小组用如下装置,进行有关碳及其氧化物的实验![]() 图中夹持仪器已略去
图中夹持仪器已略去![]() 。在完成气密性检查后加入药品,并已设法在装置中充满二氧化碳。
。在完成气密性检查后加入药品,并已设法在装置中充满二氧化碳。
(1)完成实验,填好表格
实验步骤 | 实验现象 | 实验分析 |
缓缓通入 | 木炭粉减少,D中有气泡、石灰水变浑浊且 ____ 。 | A中发生反应的化学方程式为 ___ 。 |
| B处玻璃管内 ___ 。 | 说明 ___ 具有还原性。 |
停止通入二氧化碳,熄灭 A、B两处火焰。 | C中 ____ 。 | C装置的作用是 __ |
(2)质疑有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由______。
(3)应用取46.4g某种铁的氧化物,用足量的CO与这种铁的氧化物充分反应,得固体33.6g,通过计算推测该铁的氧化物中Fe与O的原子个数比______。
【答案】D少量石灰水进入E中 C+CO2 ![]() 2CO 黑色粉末变红 进入液体 防止液体倒吸进入玻璃管 不需要 因D装置可以收集(或CO不会排出而污染空气) 3:4
2CO 黑色粉末变红 进入液体 防止液体倒吸进入玻璃管 不需要 因D装置可以收集(或CO不会排出而污染空气) 3:4
【解析】
(1)①点燃A处酒精喷灯一段时间,碳还原二氧化碳生成一氧化碳,因此木炭粉减少,反应产生的二氧化碳及剩余的一氧化碳进入D中,二氧化碳能使石灰水变浑浊,同时D装置中液体被进入没有反应的气体压出D装置进入E;碳还原二氧化碳生成一氧化碳,化学方程式为:C+CO2![]() 2CO;
2CO;
②点燃B处酒精灯,一段时间,前面碳还原二氧化碳生成一氧化碳,一氧化碳和氧化铜反应生成铜和二氧化碳,因此B处黑色粉末变为红色,说明一氧化碳具有还原性;
③停止通入二氧化碳,熄灭A、B两处的火焰,C中气压减小,D中的液体倒吸,所以C中现象是进入液体,C装置的作用是防止液体倒吸进入玻璃管;
(2)该装置不需要添加尾气处理装置,因为过量一氧化碳已收集在D中,并没有排放到空气中,不会造成污染;
(3)46.4g某种铁的氧化物,用足量的CO与这种铁的氧化物充分反应,得固体33.6g,其中33.6g是铁元素质量,所以铁的氧化物中氧元素质量为:46.4g-33.6g=12.8g,所以铁的氧化物中Fe与O的原子个数比:![]() :
:![]() =3:4。
=3:4。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】根据如表信息,相关说法正确的是( )
温度℃ | 溶解度/g | |||
NaCl | KCl | NH4Cl | KNO3 | |
20 | 36.0 | 34.0 | 37.2 | 31.6 |
40 | 36.6 | 40.0 | 45.8 | 63.9 |
60 | 37.3 | 45.5 | 55.2 | 110 |
A. 20℃时,NaCl的溶解度为36.0
B. 40℃时,KCl饱和溶液的溶质质量分数为40%
C. 60℃降温到20℃时,KNO3和KCl的饱和溶液析出晶体较多的是KNO3
D. 40℃时,向100g水中加入50gNH4Cl充分溶解,溶液质量为145.8g
【题目】取四份大理石样品分别和稀盐酸反应,实验数据记录如下表。(杂质既不溶于水也不跟酸反应)
第1份 | 第2份 | 第3份 | 第4份 | |
大理石样品质量(g) | 3.0 | 3.0 | 3.0 | 3.0 |
稀盐酸质量(g) | 5.0 | 10.0 | 15.0 | 20.0 |
产生气体质量(g) | 0.44 | 0.88 | 0.99 | X |
回答下列有关问题:
(1)仔细观察第1份和第2份实验数据,会发现生成气体的质量不相同。据此判断,在第1份样品的实验中,_____(填“大理石”或者“稀盐酸”)完全反应;生成的气体通入澄清石灰水中,发生反应的化学方程式为_____;
(2)同理,比较第2份和第3份实验数据,可以判断其中第_____份大理石样品反应完全。那么,第4份数据中的x值应该为_____;
(3)计算:该大理石样品中碳酸钙的质量分数。___(依据化学方程式,写出计算过程)