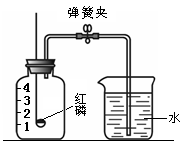
题目内容
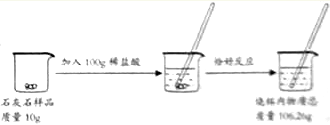
【题目】鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中碳酸钙的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g的稀盐酸,使之充分反应(鸡蛋壳中除碳酸钙外的其他成分不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),试计算:
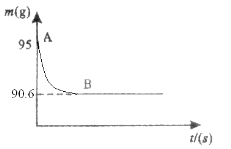
(1)生成二氧化碳的质量;
(2)该鸡蛋壳中碳酸钙的质量分数(计算结果精确到0.1%)。
【答案】(1) 4.4g (2)66.7%
【解析】
试题分析:根据质量守恒定律可以知道反应前的总质量和反应后的总质量不会改变,所以生成二氧化碳的质量=95-90.6=4.4克,解设:鸡蛋壳中的碳酸钙的质量为X,
CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
44
X 4.4克
列比例式得:100:X=44:4.4克 解得X=10克
所以该鸡蛋壳中碳酸钙的质量分数=10/15×100%=66.7%

【题目】(6分)请应用质量守恒定律的有关知识,完成下列各题。
(1)硅(Si)是太阳能电池和电脑芯片中不可缺少的材料。生产硅的化学反应为SiO2 + 2C 高温 Si+2X↑。则X 的化学式为 。
(2)过氧化钙(CaO2)常用于鱼池供氧剂,它与水反应,生成氧气和氢氧化钙,该反应的化学方程式为 。
(3)在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。
物 质 | 氧 气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
①X的数值为 。
②W中含有的元素是 。
(4)下图是工业上制备氢气的微观示意图,其中不同的“球”代表不同的原子。下列说法不正确的是 (填字母序号)。

A.反应前后,分子个数不变
B.反应前后,原子的种类、数目不变
C.该反应中共涉及两种单质和三种化合物
D.该反应中参加反应的两种分子的个数比为1︰1