题目内容
【题目】工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3)来制取绿矾(FeSO4.7H2O),实现变废为宝,减少环境污染。简易流程如下:

(1)反应①和反应③都要进行的操作是____________;
(2)反应②中发生置换反应的化学方程式为 __________________________;
(3)用NaOH溶液控制pH的目的是___________________________________;
(4) 溶液B中含有的溶质一定有硫酸亚铁和_________________(填化学式)。
【答案】 过滤 Fe+H2SO4=FeSO4+H2↑;Fe+Fe2(SO4)3=3FeSO4 使Al3+完全转化为Al(OH)3沉淀 硫酸钠
【解析】(1)由反应的流程图可知,通过反应①和反应③都分别得到了固体和溶液,故都要进行过滤操作;(2)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。反应①中加入的稀硫酸是过量的,故加入铁粉后,铁粉能与稀硫酸反应生成硫酸亚铁和氢气,铁粉与Fe2(SO4)3反应,反应的化学方程式表示为:Fe+H2SO4=FeSO4+H2↑;Fe+Fe2(SO4)3=3FeSO4(3)该实验的目的是得到绿矾,故要把硫酸铝除去,加入氢氧化钠溶液控制pH的目的是使Al3+完全转化为Al(OH)3沉淀除去;(4)氢氧化钠与硫酸铝反应生成硫酸钠和氢氧化铝沉淀,故溶液B中一定含有硫酸钠。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
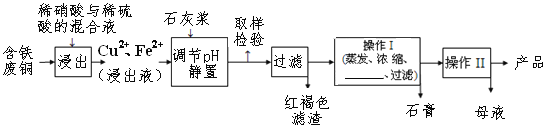
启东小题作业本系列答案【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)石灰浆调pH大约要调节到__________
A. 2 B. 5 C. 7 D.10
(3)含铁的废铜和稀硫酸反应的化学方程式________________________________;
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、__________、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_________________。