题目内容
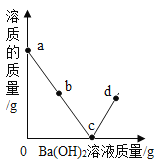
【题目】有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:
(1)赤铁矿中氧化铁的质量分数是 ;
(2)计算所使用的稀盐酸的溶质质量分数。
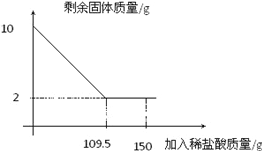
【答案】解:(1)80%;
(2)设参加反应的盐酸的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
8g x
160/8g=219/x
x=10.95g
所以所使用的稀盐酸的溶质质量分数为:10.95g÷109.5g×100%=10%;
【解析】氧化铁和稀盐酸反应生成易溶于水的氯化铁和水,所以反应中固体质量减少,最终不溶的固体是杂质,所以氧化铁的质量为:10g-2g=8g,设所使用的稀盐酸的溶质质量为x,
Fe2O3+6HCl=2FeCl3+3H2O
160 219
8g x
160/8g=219/x
x=10.95g
所以所使用的稀盐酸的溶质质量分数为:10.95g÷109.5g×100%=10%;
答:略

练习册系列答案
相关题目