题目内容
【题目】萍乡的著名景点“孽龙洞”是由石灰岩被地下水及空气长期冲蚀而成,石灰岩的主要化学成分为碳酸钙(CaCO3),生产中可用来制取熟石灰[Ca(OH)2],若生产工艺中钙元素的质量保持不变,试问:
(1)200吨碳酸钙(CaCO3)中含钙元素________吨?(要求写出计算过程)
(2)200吨碳酸钙(CaCO3)在理论上可制得熟石灰[Ca(OH)2]_______吨?(要求写出计算过程)
【答案】80吨 147.9吨
【解析】
(1)碳酸钙中碳元素的质量分数:![]() ,200吨碳酸钙(CaCO3)中含钙元素:
,200吨碳酸钙(CaCO3)中含钙元素:![]() 。故填:80吨。
。故填:80吨。
(2)200吨碳酸钙(CaCO3)中含钙元素80t,在理论上可制得熟石灰[Ca(OH)2]中也含有钙元素80t,熟石灰[Ca(OH)2]中钙元素的质量分数:![]() ,则含有80t钙元素的熟石灰[Ca(OH)2]的质量:
,则含有80t钙元素的熟石灰[Ca(OH)2]的质量:![]() 。故填:147.9t。
。故填:147.9t。

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
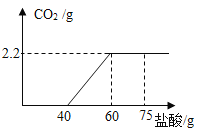
【题目】生铁和钢都是由铁和碳组成的合金。为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示,请根据相关信息完成下列计算:
烧杯质量 | 样品的质量 | 稀盐酸的质量 | 烧杯+剩余物的总质量 |
50g | 5.8g | 94.6g | 150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
(1)铁合金属于__________材料(填“金属”或“合成”);
(2)样品中碳的质量分数(计算结果保留到 0.1%)_______。