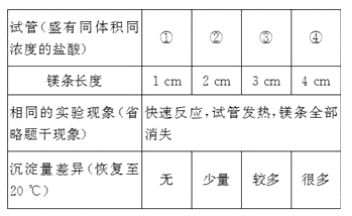
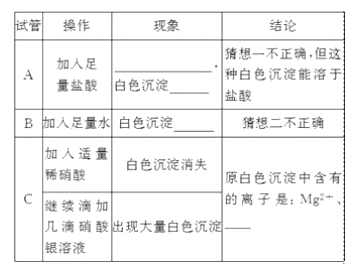
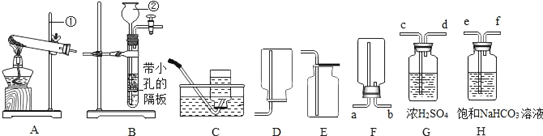
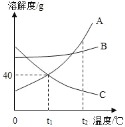
题目内容
【题目】将12.5g的大理石(杂质不参加反应,也不溶于水)放到盛有100g稀盐酸中的烧杯中,恰好完全反应。反应后烧杯内物质的总质量为108.1g,求:
(1)生成二氧化碳_____g。
(2)所用100g稀盐酸中溶质的质量分数_____。
【答案】4.4 10%
【解析】
(1)根据该反应中只有二氧化碳是气体,则利用质量守恒定律和反应前后烧杯中物质的总质量之差来计算二氧化碳的质量;
(2)将二氧化碳的质量代入化学反应方程式来计算稀盐酸溶质的质量,再计算稀盐酸的质量分数。
解:(1)反应前烧杯中物质的总质量为12.5g+100g=112.5g,反应后烧杯内物质的质量变为108.1g,由质量守恒可知,二氧化碳的质量为112.5g-108.1g=4.4g;
(2)设100g稀盐酸中溶质的质量为x,
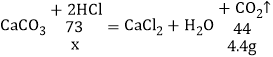
![]()
x═7.3g,
所用100g稀盐酸中溶质的质量分数为![]() ×100%=7.3%;
×100%=7.3%;
答:100g稀盐酸中溶质的质量分数是7.3%。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目