题目内容
【题目】某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【猜想与假设】:他们对固体成分进行如下猜想:
猜测一:可能是氧氧化钠
猜测二:可能是________________________;
猜测三:可能是氧氧化钠和碳酸钠
【进行实验】:
为探究固体的成分,他们将该固体溶于水,得到无色溶液,再迸行了如下实验:
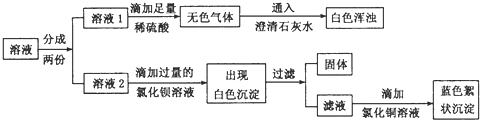
(1)根据实验现象推测,白色沉淀是____________________________。
(2)在溶液2中滴加过量氯化钡溶液的目的是________________________________,该反应的化学方程式是_________________________________________________。
【得出结论】:
(3)由实验现象可知,猜测______是正确的。
【交流与反思】:
(4)久置的氢氧化钠变质的原因是(用化学反应方程式表示)______________________,所以氢氧化钠必须_______________________保存。
【答案】 碳酸钠 BaCO3 除尽溶液中的碳酸钠 Na2CO3+BaCl2=BaCO3↓+2NaCl 三 2NOH+CO2= Na2CO3+H2O 密封
【解析】【猜想与假设】猜测二:根据氢氧化钠固体的变质情况分析解答;
【进行实验】(1)根据氯化钡与碳酸钠反应生成碳酸钡解答;
(2)根据过量氯化钡与碳酸钠反应生成碳酸钡和氯化钠解答;
【得出结论】(3)根据实验现象解答;
【交流与反思】(4)根据氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水解答。
解:【猜想与假设】氢氧化钠固体可能未变质,也可能部分变质,还可能全部变质。由此可知,猜测二:可能是碳酸钠;
【进行实验】(1)氯化钡与碳酸钠反应生成碳酸钡。故根据实验现象推测,白色沉淀是BaCO3 ;
(2)在溶液2中滴加过量氯化钡溶液的目的是除尽溶液中的碳酸钠;反应的化学方程式是Na2CO3+BaCl2=BaCO3↓+2NaCl;
【得出结论】(3)向溶液2中加入氯化钡溶液生成白色沉淀,过滤,得到滤液。说明溶液2中有碳酸钠。再向滤液中加入氯化铜溶液得到蓝色沉淀,说明滤液中有氢氧化钠。由此可知,猜测三是正确的;
【交流与反思】(4)久置的氢氧化钠变质的原因是2NOH+CO2= Na2CO3+H2O;所以氢氧化钠必须密封保存。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
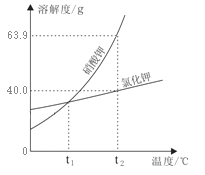
孟建平错题本系列答案【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液