题目内容
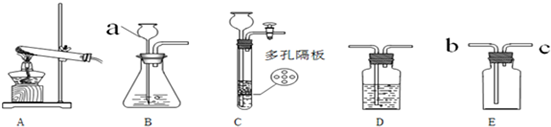
(1)若要制取二氧化碳,在B装置中装有石灰石,那么a中应加入
(2)实验室如用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔隔板用来放块状固体),其优点是
考点:二氧化碳的实验室制法,气体的干燥(除水),书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)从石灰石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.由于反应物是固体和液体且反应条件是不需要加热,故发生装置为B,由于浓硫酸具有吸水性且不和二氧化碳反应,如果用E装置收集二氧化碳,收集时应从b导管进入,由于二氧化碳的密度比空气大,氧气沉积在集气瓶的底部,由下而上,充满集气瓶去分析解答;
(2)在C装置中,把固体放在隔板上,液体通过长颈漏斗加入,使用时,让液体与固体接触,反应开始,产生气体;不用时,可把导气管用止水夹夹住,产生的气体不能导出试管,造成试管内气体越来越多,压强越来越大,液体被压到长颈漏斗中,固体和液体分离,反应停止去分析解答.
(2)在C装置中,把固体放在隔板上,液体通过长颈漏斗加入,使用时,让液体与固体接触,反应开始,产生气体;不用时,可把导气管用止水夹夹住,产生的气体不能导出试管,造成试管内气体越来越多,压强越来越大,液体被压到长颈漏斗中,固体和液体分离,反应停止去分析解答.
解答:解:(1)石灰石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;由于反应物是固体和液体且反应条件是不需要加热,故发生装置为B,由于浓硫酸具有吸水性且不和二氧化碳反应,所以可用来干燥二氧化碳气体;如果用E装置收集二氧化碳,收集时应从b导管进入,由于二氧化碳的密度比空气大,氧气沉积在集气瓶的底部,由下而上,充满集气瓶;故答案为:稀盐酸 反应物是固体和液体 不需加热 CaCO3+2HCl=CaCl2+H2O+CO2↑ 浓硫酸 b;
(2)在C装置中,把固体放在隔板上,液体通过长颈漏斗加入,使用时,让液体与固体接触,反应开始,产生气体;不用时,可把导气管用止水夹夹住,产生的气体不能导出试管,造成试管内气体越来越多,压强越来越大,液体被压到长颈漏斗中,固体和液体分离,反应停止.故答案为:能随时控制反应的开始和终止.
(2)在C装置中,把固体放在隔板上,液体通过长颈漏斗加入,使用时,让液体与固体接触,反应开始,产生气体;不用时,可把导气管用止水夹夹住,产生的气体不能导出试管,造成试管内气体越来越多,压强越来越大,液体被压到长颈漏斗中,固体和液体分离,反应停止.故答案为:能随时控制反应的开始和终止.
点评:发生装置的选择取决于反应物的状态和反应条件,收集装置的选择则取决于制取气体的水溶性和密度.

练习册系列答案
相关题目
下列反应中属于氧化反应,但不属于化合反应的是( )
A、高锰酸钾
| ||
B、硫+氧气
| ||
C、氢气+氧
| ||
D、酒精+氧气水
|
 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
 请根据题目要求回答下列问题.
请根据题目要求回答下列问题.