题目内容
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
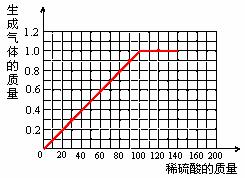
| 取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第 份开始,金属已经反应完全了。
(2)列式计算该黄铜样品中金属锌的质量分数。(要求写出计算过程)
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线。
4 解:设40g样品中含锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1
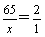
∴x=32.5(g)
∴黄铜样品中锌的质量分数为
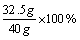 =81.25%
=81.25%
答:黄铜样品中锌的质量分数为81.25%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 体溶解忽略不计).
体溶解忽略不计).