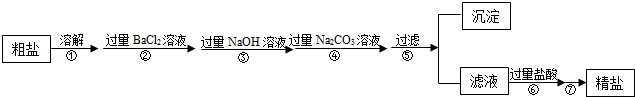
��Ŀ����
ij������Һ�к����Ȼ��ơ��Ȼ�ͭ���Ȼ�������ij����С��Ҫ�ӷ�Һ�л���ͭ���õ����죨��Ҫ�ɷ�Fe2O3����Ҫ��ȫ���̲�������������Ԫ�ء����ʵ�鷽������ͼ��ʾ��
�ش��������⣺
��1���������A�ܽ���ٽ��в���aʱ�������������� ��
��2��������Һ�м������A��Ӧ�Ļ�ѧ����ʽΪ ��
��3�������ҵ���Ҫ�ɷ��� ��
��4����������������Ҫԭ�ϣ���CO�����������Ļ�ѧ����ʽΪ ��
��5��ij�о���ѧϰС���ͬѧΪ�˲ⶨij������������Ʒ������������������ʵ������
��ȡ������Ʒ5.8g�����ձ��У�Ȼ���ټ���������ϡ���ᣬʹ֮��ַ�Ӧ����
����0.2g���������ʲ��μӷ�Ӧ�������������Ʒ��������������Ϊ �����г�������̣�����һλС������

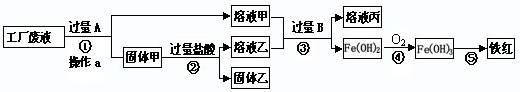
�ش��������⣺
��1���������A�ܽ���ٽ��в���aʱ�������������� ��
��2��������Һ�м������A��Ӧ�Ļ�ѧ����ʽΪ ��
��3�������ҵ���Ҫ�ɷ��� ��
��4����������������Ҫԭ�ϣ���CO�����������Ļ�ѧ����ʽΪ ��
��5��ij�о���ѧϰС���ͬѧΪ�˲ⶨij������������Ʒ������������������ʵ������
��ȡ������Ʒ5.8g�����ձ��У�Ȼ���ټ���������ϡ���ᣬʹ֮��ַ�Ӧ����
����0.2g���������ʲ��μӷ�Ӧ�������������Ʒ��������������Ϊ �����г�������̣�����һλС������
1������
��2��Fe+CuCl2 = FeCl2+Cu
��3��ͭ
��4��3CO+ Fe2O3 2Fe+3CO2
2Fe+3CO2
��5��96.6%
��2��Fe+CuCl2 = FeCl2+Cu
��3��ͭ
��4��3CO+ Fe2O3
 2Fe+3CO2
2Fe+3CO2��5��96.6%
���������
��������a�õ��˹����Һ�壬������a�ǹ��˲���������ʱҪ�ò�����������
��Һ�к����Ȼ��ơ��Ȼ�ͭ���Ȼ�������Ҫ���Ȼ�ͭ��ȥ�ֲ�������������Ԫ�ؿɼ������������û���Ӧ��ͭ�û���������˳�ȥ����Fe+CuCl2 = FeCl2+Cu
��3����������Ҫԭ����һ����̼������������Ӧ�������Ͷ�����̼��
3CO+ Fe2O3
 2Fe+3CO2
2Fe+3CO2 ��4�����������Ͻ𣬳��������̼�����ʣ�������Ʒ�м���������ϡ�������������ᷴӦ����������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2�������û�ѧ����ʽ�����������������ȣ�����������������������Ʒ������������
��μӷ�Ӧ����������Ϊx
Fe+H2SO4=FeSO4+H2��
56 2
x 0.2g
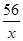 =
=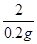
��ã�x=5.6g
������������������=
 ��100%=96.6%
��100%=96.6%
��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 12CO2��+ 10H2O��+ 6X��+ O2��
12CO2��+ 10H2O��+ 6X��+ O2��
 C2H4+4H2O������24g H2ת��CO2����������������C2H4������Ϊ���ٿˣ�
C2H4+4H2O������24g H2ת��CO2����������������C2H4������Ϊ���ٿˣ�