题目内容
【题目】(9分)某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量分数(假设杂质不参与反应)。草酸晶体(H2C2O4·2H2O)的部分理化性质见下表:
熔 点 | 沸 点 | 热 稳 定 性 | 与 碱 反 应 |
101℃~102℃ | 150℃~160℃ 升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |
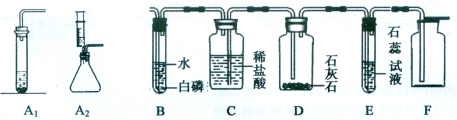
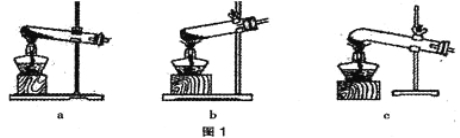
(1)图1是加热装置。最适宜的加热分解草酸晶体装置是 。
(2)图 2 是验证热分解产物中含 CO 、CO2的装置。
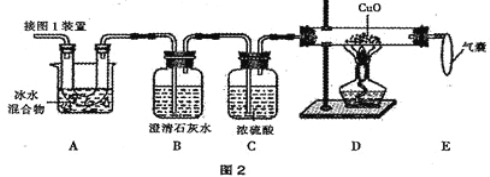
①装置 A 的主要作用是_______________ _ _____。
②气囊的作用是____________________。
③证明存在 CO2的现象是_ ,B中反应的化学方程式 。
④证明存在 CO 的现象是_______ _______。
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因_______(写一条即可)。
(4)称取17.5g草酸晶体样品配制50.00g溶液,加适量的稀硫酸,然后滴加KMnO4 溶液(含KMnO47.9克) 恰好反应完全。
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
请计算样品中草酸晶体(H2C2O4·2H2O )的质量分数。(写出计算过程)
[有关物质的相对分子质量:Mr(H2C2O4)=90,Mr(H2C2O42H2O)=126,Mr(KMnO4)=158 ]
【答案】(1)装置是C
(2)①装置A主要的作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰
②气囊的作用是收集未反应的一氧化碳,防止空气污染③证明存在 CO2的现象是B装置内的澄清石灰水变浑浊,B中反应的化学方程式:CO2 + Ca(OH)2 = CaCO3↓+ H2O ④证明存在 CO 的现象是 D装置中黑色固体变红
(3)可能原因:一氧化碳没有全部与氧化铜反应(其他合理答案也可以)
(4)计算样品中草酸晶体(H2C2O4·2H2O )的质量分数。
15.75g 90%
【解析】
试题分析:(1)草酸的熔点较低,受热容易熔化,用c装置加热草酸时水不易下流,适宜用来加热草酸。故选C
(2)①装置 A 的主要作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰②气囊的作用是收集一氧化碳,防止污染空气;③证明存在 CO2的现象是B装置内澄清石灰水变浑浊,B中反应的化学方程式CO2 + Ca(OH)2 = CaCO3↓+ H2O。④证明存在 CO 的现象是D中黑色固体逐渐变为红色;
(3)计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因一氧化碳未完全反应,或生成的铜又被氧化成氧化铜。
(4)利用化学方程式进行计算即可。
设草酸的质量为X
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
316 450
7.9克 X
316/450=7.9克/X X=11.25克
设草酸晶体质量为Y
依据5H2C2O4-----5 H2C2O4·2H2O
450 630
11.25克 Y
450/630=11.25克/Y Y=15.75克
所以样品中草酸晶体质量分数=15.75克/17.5g×100%=90%