题目内容
 (1)在生活中我们知道这样的事实:①食盐易溶于水,而难溶于植物油;②硝酸钾易溶于水,而碳酸钙难溶于水; ③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多.
(1)在生活中我们知道这样的事实:①食盐易溶于水,而难溶于植物油;②硝酸钾易溶于水,而碳酸钙难溶于水; ③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多.
上述事实①②③分别说明,固体物质的溶解度主要与______、______、______三个因素有关.
(2)将一块塑料板放入50℃的硝酸钾饱和溶液中,塑料板漂浮于液面上(如图1).若将溶液降温到20℃时,可观察到的现象是______;______.若要看到塑料板上浮,应采用的方法是______.
(3)常温下,向盛有几小粒硝酸钾晶体的试管中,加入饱和硝酸钾溶液,并固定在盛有水的烧杯中(如图2所示).
小军同学向烧杯中加入某种物质后并搅拌,结果试管中的晶体消失了.请你猜测,小军同学加入的物质可能是______、______.
解:(1)①食盐易溶于水,而难溶于植物油,溶质相同溶剂不同,说明溶剂的影响;
②硝酸钾易溶于水,而碳酸钙难溶于水,溶剂相同溶质不同,说明溶质性质的影响;
③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多,溶质相同溶剂相同,温度不同,说明温度的影响.
故答案为:溶剂性质;溶质性质;温度;
(2)硝酸钾的溶解度随温度降低而减小,降低温度,就会析出晶体,溶液中硝酸钾含量就会减小,溶液密度减小,从而浮力减小,硝酸钾的溶解度减小导致塑料块下沉;硝酸钾晶体析出,导致溶液的密度减小,浮力减小.如要使其上浮则必须使溶液的溶质质量分数增大,溶解度升高,方法可是升温或加入其它溶液.
故答案为:烧杯底部有晶体析出;塑料块下沉;升高温度,加入氯化钠固体(或升高温度后再加硝酸钾固体等);
(3)硝酸钾溶解度随温度升高而增大,向烧杯中加入某种物质后并搅拌,结果试管中的硝酸钾晶体消失了,说明加入的物质溶于水或与水反应放出大量热,使温度升高.浓硫酸、氢氧化钠溶于水放出大量的热,生石灰与水反应放出大量的热.
故答案为:氢氧化钠固体;生石灰固体.
分析:(1)利用固体溶解度影响因素来解答此题.
(2)理解影响固体溶解度的外在因素---温度,弄清固体的溶解度和温度之间的关系.如要是木块上浮就应该改变溶液的密度,使其变大.
(3)硝酸钾晶体消失说明该溶液又能继续溶解,故向烧杯中加入的物质与水混合后改变了硝酸钾饱和溶液的温度.由于硝酸钾溶解度随温度升高而增大,故向烧杯中加入的物质溶于水或与水反应放出大量热.
点评:此题考查了影响固体溶解度的因素,锻炼了学生分析问题解决问题的能力;结合饱和溶液与不饱和溶液的转化考查物质溶解过程中的热量变化,试管中的晶体消失的原因是分析问题的突破口.
②硝酸钾易溶于水,而碳酸钙难溶于水,溶剂相同溶质不同,说明溶质性质的影响;
③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多,溶质相同溶剂相同,温度不同,说明温度的影响.
故答案为:溶剂性质;溶质性质;温度;
(2)硝酸钾的溶解度随温度降低而减小,降低温度,就会析出晶体,溶液中硝酸钾含量就会减小,溶液密度减小,从而浮力减小,硝酸钾的溶解度减小导致塑料块下沉;硝酸钾晶体析出,导致溶液的密度减小,浮力减小.如要使其上浮则必须使溶液的溶质质量分数增大,溶解度升高,方法可是升温或加入其它溶液.
故答案为:烧杯底部有晶体析出;塑料块下沉;升高温度,加入氯化钠固体(或升高温度后再加硝酸钾固体等);
(3)硝酸钾溶解度随温度升高而增大,向烧杯中加入某种物质后并搅拌,结果试管中的硝酸钾晶体消失了,说明加入的物质溶于水或与水反应放出大量热,使温度升高.浓硫酸、氢氧化钠溶于水放出大量的热,生石灰与水反应放出大量的热.
故答案为:氢氧化钠固体;生石灰固体.
分析:(1)利用固体溶解度影响因素来解答此题.
(2)理解影响固体溶解度的外在因素---温度,弄清固体的溶解度和温度之间的关系.如要是木块上浮就应该改变溶液的密度,使其变大.
(3)硝酸钾晶体消失说明该溶液又能继续溶解,故向烧杯中加入的物质与水混合后改变了硝酸钾饱和溶液的温度.由于硝酸钾溶解度随温度升高而增大,故向烧杯中加入的物质溶于水或与水反应放出大量热.
点评:此题考查了影响固体溶解度的因素,锻炼了学生分析问题解决问题的能力;结合饱和溶液与不饱和溶液的转化考查物质溶解过程中的热量变化,试管中的晶体消失的原因是分析问题的突破口.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 (一)人类生活离不开金属.
(一)人类生活离不开金属. (2013?湘潭)化学与生活息息相关,我们的生活离不开化学.
(2013?湘潭)化学与生活息息相关,我们的生活离不开化学.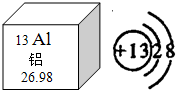 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.