题目内容
 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.(1)①铝在地壳中的含量居所有金属元素的第
1
1
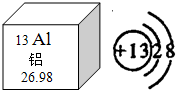
位,根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为13
13
,如图微粒结构示意图表示B
B
(填序号)A.铝原子 B.铝离子 C.铝分子
②工业上用电解氧化铝制取金属铝,同时生成一种常见的气体.反应的方程式为
2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
.
| ||
③工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.化学反应方程式为
Al2O3+N2+3C
2AlN+3CO
| ||
Al2O3+N2+3C
2AlN+3CO
.
| ||
(2)铝合金比单质铝有着更为广泛的应用.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
[查阅资料]铝与氢氧化钠溶液反应方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
[猜 想]猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有
铜
铜
.猜想3:该合金粉末中除铝外,还含有铁、铜.
[实验探究]下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 铝 铝 . |
| ②取步骤①所得滤渣,加过量的 10%盐酸 10%盐酸 ,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜 铁和铜 . |
[反 思]一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.等质量铝与足量盐酸反应生成的氢气比其与足量氢氧化钠溶液生成的氢气
A
A
(选填序号)A.多 B.少 C.相等 D.无法比较
(3)在烧杯中加入4.28g久置空气中的铝箔,再滴加稀盐酸,放出气体的质量与所加稀盐酸质量的关系如右图所示.请回答下列问题:
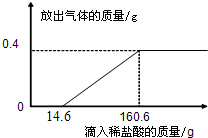
①产生氢气
0.4
0.4
g.②刚开始没有氢气放出的原因是铝箔表面有
致密
致密
(选填“致密”或“疏松”)的氧化层.氧化层与稀盐酸反应生成易溶于水的氯化铝和水,反应方程式为Al2O3+6HCl=2AlCl3+3H2O
Al2O3+6HCl=2AlCl3+3H2O
.③所滴加的稀盐酸中溶质的质量分数.
分析:(1)根据地壳中元素的含量和元素周期表中的元素的信息进行分析解答;根据化学方程式的书写原则,找出反应物和生成物正确书写化学方程式;
(2)根据题目所给信息,在验证合金中是否有铝时,我们可以利用铝和氢氧化钠溶液反应生成偏铝酸钠和氢气来鉴定.而铁和铜在鉴定时,可以根据铁与氢氧化钠不反应而与盐酸反应,铜两者都不反应来进行;
(3)根据铝箔和稀盐酸反应化学方程式,结合题干中的右图所示,看出开始加稀盐酸没产生氢气,当加入14.6g稀盐酸时才产生氢气,说明久置的铝箔表面被氧化,当加稀盐酸的量至160.6g时,铝箔和硫酸恰好完全反应,产生0.4g氢气,再根据所产生氢气的质量求出参加反应的硫酸的质量和铝的质量,那么题干中的求答问题就会迎刃而解.
(2)根据题目所给信息,在验证合金中是否有铝时,我们可以利用铝和氢氧化钠溶液反应生成偏铝酸钠和氢气来鉴定.而铁和铜在鉴定时,可以根据铁与氢氧化钠不反应而与盐酸反应,铜两者都不反应来进行;
(3)根据铝箔和稀盐酸反应化学方程式,结合题干中的右图所示,看出开始加稀盐酸没产生氢气,当加入14.6g稀盐酸时才产生氢气,说明久置的铝箔表面被氧化,当加稀盐酸的量至160.6g时,铝箔和硫酸恰好完全反应,产生0.4g氢气,再根据所产生氢气的质量求出参加反应的硫酸的质量和铝的质量,那么题干中的求答问题就会迎刃而解.
解答:解:
(1)①根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,铝在地壳中的含量居所有金属元素的第1位;根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为13,;核内质子数不等于核外电子数,故表示铝离子,故选B;
②由题意结合质量守恒定律,在通电的条件下,氧化铝分解得到金属铝和氧气,电解氧化铝的化学方程式为:2Al2O3
4Al+3O2↑.
③根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,化学方程式为:Al2O3+N2+3C
2AlN+3CO;
(2)根据所给的猜想我们可以确定猜想2,可能含有铜.而在检验合金的组成时,可以利用合金中不同的金属的不同化学性质和所给的信息来进行了鉴定.检验是否含有铝时,用氢氧化钠和铝反应生成氢气来确定.而检验是否有铁时,可用稀盐酸来检验.检验是否有铜时,利用铜和稀盐酸不能反应来进行.
故答案为:
【猜想】猜测2:铜
实验探究
【反思】铝与盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑;
铝与氢氧化钠反应的化学方程式为:2Al+2NaOH=2NaAlO2+H2↑;
由方程式可以看出,相同质量的铝与盐酸反应放出的氢气比与氢氧化钠反应放出的氢气多;
(3)①由图可以看出生成氢气的质量为0.4g;
②刚开始没有氢气放出的原因是铝箔表面有致密的氧化层三氧化二铝;三氧化二铝与稀盐酸反应生成氯化铝和水,反应方程式为:Al2O3+6HCl=2AlCl3+3H2O;
③与铝反应的盐酸的质量为160.6g-14.6g=146g,设盐酸的溶质的质量分数为x
2Al+6HCl=2AlCl3+3H2↑
219 6
146g×x 0.4g
=
解得x=10%
答:所用盐酸溶质的质量分数为10%.
故答案为:(1)①1;13;B;②2Al2O3
4Al+3O2↑;③Al2O3+N2+3C
2AlN+3CO;
(2)【猜想】猜测2:铜
实验探究
【反思】A;
(3)①0.4;②致密;Al2O3+6HCl=2AlCl3+3H2O;③10%;
(1)①根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,铝在地壳中的含量居所有金属元素的第1位;根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为13,;核内质子数不等于核外电子数,故表示铝离子,故选B;
②由题意结合质量守恒定律,在通电的条件下,氧化铝分解得到金属铝和氧气,电解氧化铝的化学方程式为:2Al2O3
| ||
③根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,化学方程式为:Al2O3+N2+3C
| ||
(2)根据所给的猜想我们可以确定猜想2,可能含有铜.而在检验合金的组成时,可以利用合金中不同的金属的不同化学性质和所给的信息来进行了鉴定.检验是否含有铝时,用氢氧化钠和铝反应生成氢气来确定.而检验是否有铁时,可用稀盐酸来检验.检验是否有铜时,利用铜和稀盐酸不能反应来进行.
故答案为:
【猜想】猜测2:铜
实验探究
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 铝. |
| ②取步骤①所得滤渣,加过量的 10%盐酸,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜. |
铝与氢氧化钠反应的化学方程式为:2Al+2NaOH=2NaAlO2+H2↑;
由方程式可以看出,相同质量的铝与盐酸反应放出的氢气比与氢氧化钠反应放出的氢气多;
(3)①由图可以看出生成氢气的质量为0.4g;
②刚开始没有氢气放出的原因是铝箔表面有致密的氧化层三氧化二铝;三氧化二铝与稀盐酸反应生成氯化铝和水,反应方程式为:Al2O3+6HCl=2AlCl3+3H2O;
③与铝反应的盐酸的质量为160.6g-14.6g=146g,设盐酸的溶质的质量分数为x
2Al+6HCl=2AlCl3+3H2↑
219 6
146g×x 0.4g
| 219 |
| 146g×x |
| 6 |
| 0.4g |
解得x=10%
答:所用盐酸溶质的质量分数为10%.
故答案为:(1)①1;13;B;②2Al2O3
| ||
| ||
(2)【猜想】猜测2:铜
实验探究
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 铝. |
| ②取步骤①所得滤渣,加过量的 10%盐酸,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜. |
(3)①0.4;②致密;Al2O3+6HCl=2AlCl3+3H2O;③10%;
点评:本题难度不大,但综合性较强,考查了化学方程式的书写、学生灵活运用所学知识解题的能力.此题考查学生会结合图示找出解题突破口,利用化学方程式进行计算,特别是解(3)步时,铝箔中铝元素的质量即包括氧化铝中的铝还包括单质铝的质量,请同学们考虑细致,思维要慎密.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
(1)①铝在地壳中的含量居所有金属元素的第______位,根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为______,如图微粒结构示意图表示______(填序号)
A.铝原子 B.铝离子 C.铝分子
②工业上用电解氧化铝制取金属铝,同时生成一种常见的气体.反应的方程式为______.
③工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.化学反应方程式为______.
(2)铝合金比单质铝有着更为广泛的应用.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
[查阅资料]铝与氢氧化钠溶液反应方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
[猜 想]猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______.
猜想3:该合金粉末中除铝外,还含有铁、铜.
[实验探究]下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有______. |
| ②取步骤①所得滤渣,加过量的______,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有______. |
[反 思]一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.等质量铝与足量盐酸反应生成的氢气比其与足量氢氧化钠溶液生成的氢气______(选填序号)
A.多 B.少 C.相等 D.无法比较
(3)在烧杯中加入4.28g久置空气中的铝箔,再滴加稀盐酸,放出气体的质量与所加稀盐酸质量的关系如右图所示.请回答下列问题:

①产生氢气______g.
②刚开始没有氢气放出的原因是铝箔表面有______(选填“致密”或“疏松”)的氧化层.氧化层与稀盐酸反应生成易溶于水的氯化铝和水,反应方程式为______.
③所滴加的稀盐酸中溶质的质量分数.



