题目内容
下面A、B、C、D、E、F是实验室制取、收集气体及氧气的化学性质实验装置图,请读题并根据各图回答以下问题:
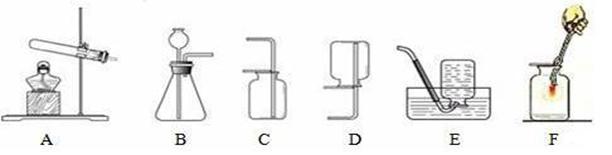
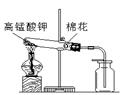
(1)实验室中常用高锰酸钾加热分解制取氧气。请回答应该选用______装置(填字母)。写出化学反应文字表达式:_________________,该反应属于______反应。
(2)被称为“绿色氧化剂”的过氧化氢俗称双氧水,是一种无色液体。其溶液在二氧化锰做催化剂的条件下能迅速分解,生成氧气。如果改用双氧水制取氧气,请回答:
①通过长颈漏斗应加入的物质是 ;锥形瓶中应放入的物质是 (填化学式)。
②写出利用该方法制取氧气反应的文字表达式: ;要想收集一瓶较为纯净的氧气,最好选择装置 (填字母)。
③请简述该方法与用高锰酸钾制取氧气相比优点有哪些。(至少写出两点)
; 。
(3)小路同学用过氧化氢制取并收集了一瓶氧气,准备做铁丝燃烧的实验,如图F所示,他在瓶底加了少量水。请你来想一想,加水的目的是 。
(4)实验室常用硫化亚铁(FeS)固体与稀硫酸(H2SO4)在常温下反应制硫化氢气体和硫酸亚铁(FeSO4)。硫化氢气体是无色有刺激性气味的气体,它的密度比空气大,可溶于水。
①试写出实验室制取硫化氢气体的化学反应的文字表达式:_________________。
②制取硫化氢时,发生装置应选用上图所示的________装置(填字母,下同);收集硫化氢气体时,只能选用__________装置。

(1)实验室中常用高锰酸钾加热分解制取氧气。请回答应该选用______装置(填字母)。写出化学反应文字表达式:_________________,该反应属于______反应。
(2)被称为“绿色氧化剂”的过氧化氢俗称双氧水,是一种无色液体。其溶液在二氧化锰做催化剂的条件下能迅速分解,生成氧气。如果改用双氧水制取氧气,请回答:
①通过长颈漏斗应加入的物质是 ;锥形瓶中应放入的物质是 (填化学式)。
②写出利用该方法制取氧气反应的文字表达式: ;要想收集一瓶较为纯净的氧气,最好选择装置 (填字母)。
③请简述该方法与用高锰酸钾制取氧气相比优点有哪些。(至少写出两点)
; 。
(3)小路同学用过氧化氢制取并收集了一瓶氧气,准备做铁丝燃烧的实验,如图F所示,他在瓶底加了少量水。请你来想一想,加水的目的是 。
(4)实验室常用硫化亚铁(FeS)固体与稀硫酸(H2SO4)在常温下反应制硫化氢气体和硫酸亚铁(FeSO4)。硫化氢气体是无色有刺激性气味的气体,它的密度比空气大,可溶于水。
①试写出实验室制取硫化氢气体的化学反应的文字表达式:_________________。
②制取硫化氢时,发生装置应选用上图所示的________装置(填字母,下同);收集硫化氢气体时,只能选用__________装置。
(1) A ; 高锰酸钾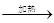 锰酸钾 + 二氧化锰 + 氧气 ;
锰酸钾 + 二氧化锰 + 氧气 ;
分解反应。
(2)
① H2O2 ;MnO2
② 过氧化氢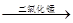 水 + 氧气 ; E。
水 + 氧气 ; E。
③ 不需要加热 ; 产物为水,不污染环境。(其他合理答案也行)
(3) 防止高温熔融物炸裂瓶底。
(4) ① 硫化亚铁 + 稀硫酸 硫酸亚铁 + 硫化氢
硫酸亚铁 + 硫化氢
② B ; C 。
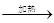 锰酸钾 + 二氧化锰 + 氧气 ;
锰酸钾 + 二氧化锰 + 氧气 ;分解反应。
(2)
① H2O2 ;MnO2
② 过氧化氢
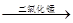 水 + 氧气 ; E。
水 + 氧气 ; E。③ 不需要加热 ; 产物为水,不污染环境。(其他合理答案也行)
(3) 防止高温熔融物炸裂瓶底。
(4) ① 硫化亚铁 + 稀硫酸
 硫酸亚铁 + 硫化氢
硫酸亚铁 + 硫化氢 ② B ; C 。
试题分析:(1)高锰酸钾加热制氧应选择固体加热装置,故应选装置A;高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应表达式为高锰酸钾
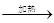 锰酸钾 + 二氧化锰 + 氧气;该反应特点为“一变多”,属于分解反应;
锰酸钾 + 二氧化锰 + 氧气;该反应特点为“一变多”,属于分解反应;(2)①通过长颈漏斗应加入的物质是液体药品过氧化氢溶液,锥形瓶中应放入的物质是二氧化锰,故填:H2O2 ;MnO2
② 过氧化氢在二氧化锰的催化作用下生成水和氧气,故表达式为:过氧化氢
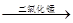 水+氧气 ;要想收集一瓶较为纯净的氧气,最好选择装置排空气法,由于氧气的密度大于空气,故选择向上排空气法,故选E装置;
水+氧气 ;要想收集一瓶较为纯净的氧气,最好选择装置排空气法,由于氧气的密度大于空气,故选择向上排空气法,故选E装置;③过氧化氢制氧比高锰酸钾制氧的优点有:不需要加热 ,节约能源;产物为水,不污染环境,环保;操作简单。
(3)铁丝在氧气中燃烧产生大量的热,做该实验时事先在集气瓶底部放少量的水是为了防止高温熔融物炸裂瓶底;
(4) ① 由题干所给信息“硫化亚铁(FeS)与稀硫酸(H2SO4)在常温下反应制硫化氢气体和硫酸亚铁(FeSO4)”可知,该反应表达式为硫化亚铁 + 稀硫酸
 硫酸亚铁 + 硫化氢;
硫酸亚铁 + 硫化氢;②该反应为固体硫化亚铁与稀硫酸溶液反应,故应选择固液制气装置B;由于硫化氢气体的密度比空气大,可溶于水,故可用向上排空气法收集,故选装置C。
点评:本题考查注重基础,主要考查了实验室制取气体的装置选取及实验和注意事项,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目