题目内容
(11分)氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是 (填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)小燕完成该实验部分操作过程如图所示,其有明显错误 (填字母序号)。
(3)操作⑤中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取
等措施。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
(5)小燕查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质;为了得到较纯净的氯化钠,小燕将除去泥沙的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种):
①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液。
从提供的试剂中选出a所代表的试剂是 、 。
②在滤液中加盐酸的作用是 、 (用化学方程式表示)。
(6)井水中也因为含有较多的MgCl2、CaCl2而不能直接饮用,上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺。活性炭在此起 作用。
(7)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,100g蒸馏水中溶解 g
硫酸钠达到饱和。将该饱和溶液升高温度至90℃,
观察到的现象是 。
(1)A (2)AC (3)间歇加热(或“来回移动酒精灯或蒸发皿”)
(4)ABD (5)①NaOH溶液、Na2CO3溶液
②HCl+NaOH=NaCl+H2O 2HCl+Na2CO3=2NaCl+CO2↑+H2O
(6)吸附 (7)50 有固体析出
解析试题分析:(1)操作①将大颗粒的粗盐变为较细的粗盐,所以操作应为研磨,必须用到的仪器是研钵。应选A项。
(2)A中瓶塞没有倒放在桌面上,C中未用玻璃棒搅拌;所以应选AC。
(3)蒸发时,如局部温度过高会造成液体因受热不均而飞溅;除搅拌外,还可通过间歇加热(或“来回移动酒精灯或蒸发皿”)等方法来控制液体温度局部过高。
(4)A.食盐没有全部溶解即过滤会使得到的食盐减少,符合题意;B.蒸发时食盐飞溅剧烈,会使得到的食盐减少,符合题意;C.蒸发后,所得精盐很潮湿会使称得的质量偏大,不符合题意;D.器皿上沾有的精盐没全部转移到称量纸上,会使得到的食盐减少,符合题意;所以应选ABD。
(5)①为了得到较纯净的氯化钠,需要加入的物质能除去MgCl2、CaCl2;可用NaOH溶液与MgCl2反应生成氢氧化镁沉淀和氯化钠;可用Na2CO3溶液与CaCl2反应生成碳酸钙沉淀和氯化钠;然后再通过过滤除去生成的两种沉淀,加入盐酸调节溶液的PH为7即可。所以a所代表的试剂是NaOH溶液和Na2CO3溶液。
②为了完全除去MgCl2、CaCl2;加入的NaOH溶液和Na2CO3溶液需要过量;所以在滤液中加盐酸是为了除去过量的NaOH和Na2CO3;反应的化学方程式为:HCl+NaOH=NaCl+H2O、2HCl+Na2CO3=2NaCl+CO2↑+H2O。
(6)活性炭具有疏松多孔的结构,有较强的吸附性,可用于净水过程中吸附水中的异味和色素,起吸附作用。
(7)根据图像可知:40℃时,硫酸钠的溶解度为50g。即在40℃时,100g蒸馏水中溶解50g硫酸钠即达到饱和。
将该饱和溶液升高温度至90℃,原来的溶质会因硫酸钠的溶液度减小而析出。所以可观察到有固体析出。
考点:常见的仪器、粗盐的提纯、实验误差分析、吸附作用、溶解度曲线

 阅读快车系列答案
阅读快车系列答案某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
(1)写出该中和反应的化学方程式_______________________。
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】
(A)溶质可能是CaCl2与Ca(OH)2
(B)溶质可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是_____________。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
| 实验步骤 | 预计现象 | 预计结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液 | | 猜想(B)正确 |
| | 猜想(C)正确 |
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH <7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀
(6分)甲为初中化学常见物质,请根据下列叙述回答问题。
(1)若甲可以用于灭火,将甲通入紫色石蕊试液中,观察到试液变红色,发生反应的化学
方程式为__________。
(2)若甲是一种红色固体氧化物,将甲放入过量的稀盐酸中,观察到固体消失, 。
反应后所得溶液的溶质为__________。
(3)若甲含有4种元素且能与稀盐酸反应产生气泡。向甲的溶液中加入过量氢氧化钠溶液,发生反应生成乙和水,但无明显现象;向反应后的溶液中逐滴滴加稀盐酸,一段时间后产生气泡。甲与氢氧化钠溶液的反应方程式为___________。
(4)若一定量的甲与乙在一定条件下发生反应,下列情况与图像的对应关系正确的是 __________ (填序号)。
| | 甲 | 乙 | y轴含义 |
| A | 生石灰 | 水 | 固体质量 |
| B | 铜锌合金粉末 | 硫酸铜溶液 | 溶液质量 |
| C | 工业炼铁的尾气 | 氢氧化钠溶液 | 气体质量 |
| D | 密闭容器中的空气 | 红磷 | 反应过程中容器内压强 |




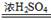 CO↑+ CO2↑+ H2O
CO↑+ CO2↑+ H2O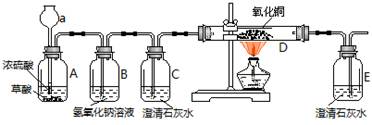
 回答下列问题:
回答下列问题: