题目内容
(6分)甲为初中化学常见物质,请根据下列叙述回答问题。
(1)若甲可以用于灭火,将甲通入紫色石蕊试液中,观察到试液变红色,发生反应的化学
方程式为__________。
(2)若甲是一种红色固体氧化物,将甲放入过量的稀盐酸中,观察到固体消失, 。
反应后所得溶液的溶质为__________。
(3)若甲含有4种元素且能与稀盐酸反应产生气泡。向甲的溶液中加入过量氢氧化钠溶液,发生反应生成乙和水,但无明显现象;向反应后的溶液中逐滴滴加稀盐酸,一段时间后产生气泡。甲与氢氧化钠溶液的反应方程式为___________。
(4)若一定量的甲与乙在一定条件下发生反应,下列情况与图像的对应关系正确的是 __________ (填序号)。
| | 甲 | 乙 | y轴含义 |
| A | 生石灰 | 水 | 固体质量 |
| B | 铜锌合金粉末 | 硫酸铜溶液 | 溶液质量 |
| C | 工业炼铁的尾气 | 氢氧化钠溶液 | 气体质量 |
| D | 密闭容器中的空气 | 红磷 | 反应过程中容器内压强 |
(1)CO2 + H2O = H2CO3
(2)无色溶液变为黄色 FeCl3、HCl
(3)NaHCO3 +NaOH = Na2CO3 + H2O (4)C
解析

 阅读快车系列答案
阅读快车系列答案(12分)油条是人们喜欢的早点,中国油条的传统加工配方是用明矾(KAl(SO4)2)作为膨松剂,明矾常引起铝残留影响人体健康问题,现在的膨松剂常用臭粉(碳酸氢铵)、小苏打。
(1)油条中的主要营养素是油脂和
(2)“铝残留影响人体健康”中的铝是指 (选填“原子”或“元素”或“单质”)
(3)已知某膨松剂含碳酸氢铵、碳酸氢钠中的一种或两种,兴趣小组对该膨松剂进行如下探究:
【查阅资料】① 2NaHCO3 Na2CO3+H2O+CO2↑; NH4HCO3
Na2CO3+H2O+CO2↑; NH4HCO3  NH3↑+H2O+CO2↑。
NH3↑+H2O+CO2↑。
②氨气能使湿润的红色石蕊试纸变蓝。浓硫酸可用于吸收氨气。
③ 碱石灰是固体氢氧化钠和氧化钙的混合物,能作干燥剂,和二氧化碳反应,不与氨气反应。
实验I:探究膨松剂的成分
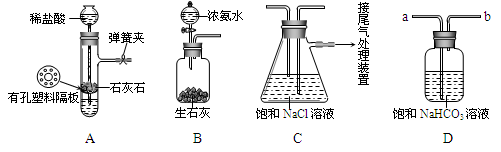
按下图所示连接好装置。
实验记录
| 实验操作 | 主要实验现象 | 实验结论 及解释 | |
| ① | 检查装置的气密性 | | 装置的气密性良好 |
| ② | 点燃酒精灯。 | 试管中白色固体减少,红色石蕊试纸 ,澄清石灰水变浑浊。 | 有二氧化碳和氨气生成 |
| ③ | 继续充分 加热 | 试管中仍有固体。 | |
得出结论:该膨松剂的成分为 (写出化学式)。
实验II:探究产生气体的量
①测定二氧化碳的质量:如下图所示装置(气密性良好,各装置中的试剂为足量)。

将8g膨松剂装入装置B中,加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接装置D、E;加热过程中,装置C的作用是 ;停止加热后,继续通入一段时间的空气,目的是 。实验中,测定实验前后装置 (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量。若没有装置A,可能会造成测定结果 (填“偏大”、“不变”或“偏小”)。
②测定氨气的质量:将上图装置中 (填字母序号) 的连接顺序为对调。另取8g膨松剂装入装置B中,通过测定实验前后盛有浓硫酸的试管质量,其质量差即为样品产生的氨气的质量。若该装置的质量增加了1.36g,则同时共产生二氧化碳质量是多少? (有计算过程,结果精确到0.01)
(7分)课外小组同学在实验室发现了一瓶标签残缺的无色液体(下图),想通过探究确定其成分,以便重新利用。
【初步分析】操作不规范可能造成标签破损,能造成标签破损的不当操作有 (写一点)。根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 20oC溶解度/g | 36 | 109 | 21.5 | 9.6 |
| 水溶液的pH | 7 | 14 | 11 | 9 |


(1)实验①观察到紫色石蕊试液变蓝,由此得出结论是 。
(2)实验②观察到有气泡产生,还有可能观察到的现象是 。
【得出结论】通过以上活动,小刚认为不能确定瓶中试剂的成分,小芳认为可以,小芳的理由是 。
【拓展应用】通过以上探究活动,小组同学联想到二氧化碳与氢氧化钠的反应,设计了如图丙所示实验,观察到的现象是 。
 2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.