题目内容
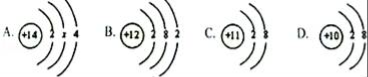
【题目】如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )

A.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液
B.t1℃时,50g甲的饱和溶液中有15g甲
C.t2℃时,甲、乙两物质溶液中溶质的质量分数相等
D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲
【答案】D
【解析】解:A、甲物质的溶解度随温度的降低而减小,所以t2℃时甲的饱和溶液降温至t1℃仍为饱和溶液,故A错误;
B、t1℃时,甲物质的溶解度是30g,所以65g甲的饱和溶液中有15g甲,故B错误;
C、t2℃时,甲、乙两物质饱和溶液中溶质的质量分数相等,故C错误;
D、甲物质的溶解度受温度影响变化较大,所以当甲中含有少量乙时,可以用降温结晶的方法提纯甲,故D正确.
故选:D.

【题目】要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与华雪同学的探究:
【查阅资料】
①碳酸亚铁(FeCO3)具有还原性,在空气中灼烧生成的氧化物和CO2气体。
②FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,四氧化三铁能与盐酸反应生成氯化亚铁、氯化铁和水。
③FeCl2能使高锰酸钾溶液褪色,而FeCl3不能;FeCl3溶液中滴加KSCN溶液,溶液变红色,FeCl2溶液中滴加KSCN溶液,溶液不出现红色。
【猜想与假设】
猜想1:固体成分是氧化铁。
猜想2:固体成分是四氧化三铁。
猜想3: 。
【活动与探究】
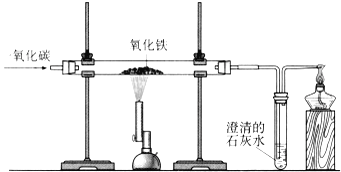
连接仪器、装好药品如图所示(加热和固定装置已省略),打开止水夹K,通入氧气,加热玻璃管X。当Y瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却。
取玻璃管里的少量固体于试管中,滴加盐酸,微热,固体完全溶解。将所得溶液分成甲、乙两份进行实验:
实验编号 | 实验步骤 | 实验现象 |
a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
b | 向乙溶液中滴加高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
【结论与反思】
(1)由上述实验现象可知,FeCO3在氧气中高温灼烧得到的固体产物是 ,因此,猜想 (填“1”或“2”或“3”)是正确的。
(2)FeCO3在氧气中高温灼烧的化学方程式为 。
(3)上述实验 (填“a”或“b”)是多余的,因为 。
【总结与提升】
(1)若实验结束时观察到Y瓶中仍然是澄清的,可能的原因是澄清石灰水的量不足,导致生成的碳酸钙转变成了可溶于水的碳酸氢钙.碳酸氢钙的化学式为 。
(2)CO2使澄清石灰水变浑浊的化学方程式为 。
(3)华雪同学经过反思,觉得该实验设计还存在问题,因为如果在实验b中观察到 ,就不能确定哪个猜想是正确的。所以华雪同学又对该实验进行了定量探究:取11.6g纯净的碳酸亚铁固体,在空气中高温灼烧至恒重,称得固体质量净减3.6g。通过计算即可确定:FeCO3和氧气充分反应后的固体成分是 。