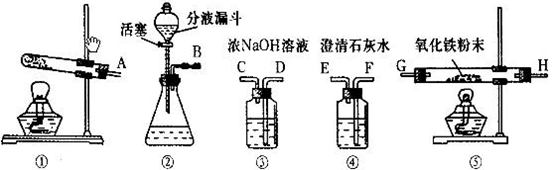
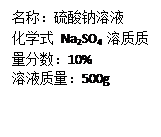题目内容
(10昆明30)(2)蒸馒头用的某纯碱中含有少量的氯化钠,为了测定该纯碱中碳酸钠和氯化钠的含量,取一定量的该纯碱样品全部溶解在100g水中,再加入氯化钙141g,恰好完全反应。(反应方程式为Na2CO3+CaCl2====CaCO3+2NaCl)经过滤、干燥后称得沉淀质量为10g,所得滤液中氯化钠的质量分数为5%,请计算:
①纯碱样品中碳酸钠的质量;
②纯碱样品中氯化钠的质量。
①纯碱样品中碳酸钠的质量;
②纯碱样品中氯化钠的质量。
解:设药品中碳酸钠的质量为x,样品中氯化钠的质量为y,反应生成氯化钠的质量为z。
Na2CO3+ CaCl2====CaCO3↓ + 2NaCl
106 100 117
X 10g z
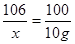 解得x=10.6g
解得x=10.6g
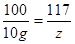 解得z=11.7g
解得z=11.7g
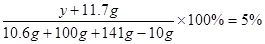 解得y=0.4g
解得y=0.4g
答(略)
Na2CO3+ CaCl2====CaCO3↓ + 2NaCl
106 100 117
X 10g z
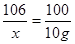 解得x=10.6g
解得x=10.6g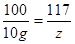 解得z=11.7g
解得z=11.7g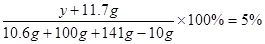 解得y=0.4g
解得y=0.4g答(略)
略

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目