题目内容
【题目】下列有关实验的叙述正确的是( )
A. 用![]() 毫升量筒量取
毫升量筒量取![]() 毫升溶液
毫升溶液
B. 用锌与浓盐酸反应来制取较纯氢气
C. 将浓氢氧化钠溶液保存在磨口玻璃塞试剂瓶中,以防氢氧化钠与空气中的二氧化碳反应
D. 一般不用稀硫酸与石灰石反应制取二氧化碳
【答案】AD
【解析】
A、选取量筒时,量筒的最大量程应大于或等于所量取液体的体积;B、由浓盐酸的物理性质进行分析判断解答;C、氢氧化钠与玻璃中的二氧化硅缓慢地发生反应;D、由实验室制取二氧化碳的反应原理进行分析判断。
A、量筒用于一定量液体的取用,使用时应尽量选取一次量取全部液体的最小规格的量筒;所以量取5.3毫升溶液可选用10毫升量筒。故选项正确;B、由于浓盐酸具有挥发性,会使制得的氢气中混有氯化氢气体,故选项错误;C、实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,故选项错误;D、如果用稀硫酸和石灰石反应,结果生成微溶性固体硫酸钙,它覆盖在石灰石表面,使酸与石灰石脱离接触,导致反应停止,故选项正确。故选AD。

【题目】某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应):
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 4.24 | 4.16 | 4.08 | 4.08 |
试计算:
(1)完全反应后产生的氧气的总质量为_______。
(2)样品中氯酸钾的纯度是多少_______?
【题目】某食品的包装袋中放有一小包“防腐剂”,化学兴趣小组的同学对“防腐剂”的成分产生了好奇,他们将一包“防腐剂”倒在滤纸上,看到“防腐剂”中有一些灰黑色粉末和一些红色粉末,为此,展开以下探究活动:
(提出问题)“防腐剂”中灰黑色的粉末和红色的粉末分别是什么?
(查阅资料)食品腐败主要是因为食品易被空气中的氧气和水蒸气氧化、潮解而变质,使用“防腐剂”可延长食品的保质期;氧化铁可与稀盐酸反应生成氯化铁和水,其溶液因电解出铁离子而呈黄色。
(提出猜想)小明:“防腐剂”中灰黑色的粉末是氧化铜,红色的粉末是铜。
小红:“防腐剂”中灰黑色的粉末是氧化铜和碳粉,红色的粉末是铜。
小军:“防腐剂”中灰黑色的粉末是铁粉和碳粉,红色的粉末是氧化铁。
(讨论分析)通过讨论,同学们一致认为小军的猜想是正确的。理由是:_______________________。
(实验探究)请你参与他们的探究,并将实验内容补充完整。
实验步骤及操作 | 实验现象 | 实验结论 |
用磁铁接近滤纸上的“防腐剂”,并充分吸引。 | 磁铁上吸引 了部分黑色物质 | ___________________ |
② 取①中剩余的粉末于试管中,加入足量的_________,观察现象。 | _________________________________ | 小军猜想成立,写出化学 方程式: _________________________ |
(拓展探究)为了进一步探究“防腐剂”的性质,兴趣小组的同学另取一包“防腐剂”粉末装入硬质玻璃管中,进行了如图所示的实验。
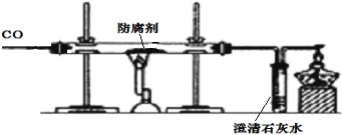
(1)该实验表现出CO具有的化学性质是___________________________。其实际操作中用量比理论值大的原因是____________________________________________。
(2)实验结束后,通过称量反应前后硬质玻璃管中固体物质的质量,他们发现反应后红色固体物质变成黑色而且的质量减小,质量减小的原因______________________。