题目内容
一定质量的稀盐酸与40克质量分数为10%的NaOH溶液反应后所的溶液pH值为7,溶质的质量分数为7.8%,求所用稀盐酸中溶质的质量分数?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:反应后所的溶液pH值为7,说明氢氧化钠和稀盐酸恰好完全反应,根据氢氧化钠的质量可以计算氯化氢的质量和氯化钠的质量,根据溶质的质量分数可以计算稀盐酸的质量,进一步可以计算所用稀盐酸中溶质的质量分数.
解答:解:设反应的氯化氢的质量为x,生成氯化钠的质量为y,稀盐酸的质量为m,
氢氧化钠的质量为40g×10%=4g,
NaOH+HCl═NaCl+H2O,
40 36.5 58.5
4g x y
=
=
,
x=3.65g,y=5.85g,
×100%=7.8%,
m=35g,
所用稀盐酸中溶质的质量分数为:
×100%=10.4%,
答:所用稀盐酸中溶质的质量分数为10.4%.
氢氧化钠的质量为40g×10%=4g,
NaOH+HCl═NaCl+H2O,
40 36.5 58.5
4g x y
| 40 |
| 4g |
| 36.5 |
| x |
| 58.5 |
| y |
x=3.65g,y=5.85g,
| 5.85g |
| 40g+m |
m=35g,
所用稀盐酸中溶质的质量分数为:
| 3.65g |
| 35g |
答:所用稀盐酸中溶质的质量分数为10.4%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
作为生活常识或认识不科学的是( )
| A、可以点火检查家中液化汽是否泄露 |
| B、缺钙易患骨质疏松 症 |
| C、我们应关爱健康、珍惜生命,远离霉变食品,香烟和毒品 |
| D、积极开发新能源 |
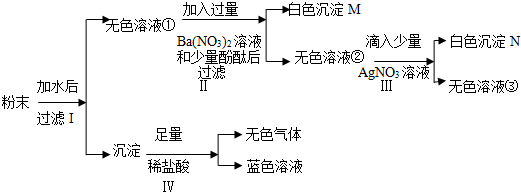
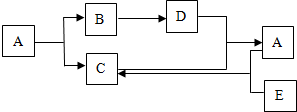
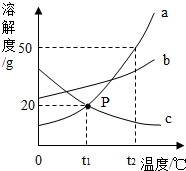 如图是三种固体物质a、b、c的溶解度曲线.
如图是三种固体物质a、b、c的溶解度曲线.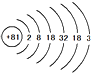 ,其原子的相对原子质量应
,其原子的相对原子质量应