题目内容
取一定质量的铜和氧化铜的混合物于烧杯中,向其中加入98g质量分数为10%的稀硫酸,恰好完全反应,得到杯内物质的总质量为118g.求:
(1)原混合物中铜的质量;
(2)反应后所得溶液中溶质的质量分数.(精确到0.1%)
(1)原混合物中铜的质量;
(2)反应后所得溶液中溶质的质量分数.(精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:将铜和氧化铜的混合物加入稀硫酸中,所发生的反应为氧化铜和稀硫酸反应,生成了硫酸铜和水,而反应是恰好完全反应,所以可以根据硫酸的质量来求算.
解答:解:设样品中CuO的质量为X,生成的CuSO4质量为Y.
CuO+H2SO4═CuSO4+H2O
80 98 160
X 98g×10% Y
=
X=8g
=
Y=16g
(1)原混合物中铜的质量=118g-98g-8g=12g
(2)反应后所得溶液的溶质质量分数为
×100%=15.1%
答案:
(1)原混合物中铜的质量12g;
(2)反应后所得溶液的溶质质量分数为15.1%.
CuO+H2SO4═CuSO4+H2O
80 98 160
X 98g×10% Y
| 80 |
| 98 |
| x |
| 98g×10% |
X=8g
| 98 |
| 98g×10% |
| 160 |
| y |
Y=16g
(1)原混合物中铜的质量=118g-98g-8g=12g
(2)反应后所得溶液的溶质质量分数为
| 16g |
| 118g-12g |
答案:
(1)原混合物中铜的质量12g;
(2)反应后所得溶液的溶质质量分数为15.1%.
点评:解答本题关键要审题,要分清数据之间的关系,在计算反应最后所得到的溶液质量时,要注意不包括没有参加反应的铜.

练习册系列答案
相关题目
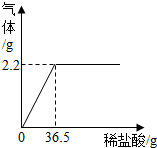 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠.为测该产品中碳酸钠的质量分数,现称取6克样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5克时,烧杯内溶液的总质量为40.3克,产生的气体质量与滴入稀盐酸的质量关系如下图所示.计算:
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠.为测该产品中碳酸钠的质量分数,现称取6克样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5克时,烧杯内溶液的总质量为40.3克,产生的气体质量与滴入稀盐酸的质量关系如下图所示.计算: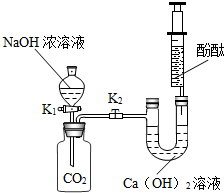 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2,请填写现象:
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2,请填写现象: