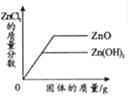题目内容
【题目】在学习酸的化学性质后,同学们做了如图所示的A、B两个实验:
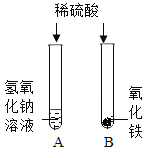
(1)A试管中发生反应的化学方程式 。向B试管中的加入足量的稀硫酸,观察到的现象是 。
(2)实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中,片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化铁。
小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质?小红、小军对此进行探究。
【实验讨论】
①小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为 。
②小军认为滤液中不可能有Fe2(SO4)3,理由是 。
【提出猜想】
猜想Ⅰ:Na2SO4 NaOH
猜想Ⅱ:
【设计实验】
实验操作 | 实验现象 | 结论 |
取少量滤液于试管中,向其中滴加酚酞试液 |
| 猜想Ⅰ成立 |
【答案】(1) 2NaOH+H2SO4═Na2SO4+2H2O;红棕色固体逐渐溶解至消失,溶液由无色变为黄色;
【实验讨论】①烧杯中生成的氢氧化铁沉淀不能与稀硫酸共存;②过滤得到无色滤液,而Fe2(SO4)3溶液是黄色溶液;【提出猜想】Na2SO4;【设计实验】酚酞试液由无色变为红色
【解析】
试题分析:(1)A试管中稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O。向B试管中的加入足量的稀硫酸,氧化铁与稀硫酸反应生成硫酸铁和水,观察到的现象是红棕色固体逐渐溶解至消失,溶液由无色变为黄色。(2)【实验讨论】①根据实验现象,生成了氢氧化铁沉淀,氢氧化铁沉淀能与稀硫酸反应,故小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,原因是烧杯中生成的氢氧化铁沉淀不能与稀硫酸共存。②烧杯中物质进行过滤得到无色滤液,Fe2(SO4)3溶液是黄色溶液,故小军认为滤液中不可能有Fe2(SO4)3。【提出猜想】氢氧化钠与B试管中的硫酸铁溶液反应生成氢氧化铁沉淀和硫酸钠,由于过滤得到无色滤液,不可能存在硫酸铁,但可能存在氢氧化钠,故猜想Ⅰ是Na2SO4、NaOH;也可能是恰好完全反应,故猜想Ⅱ:是Na2SO4。【设计实验】设计实验证明是否存在氢氧化钠即可,氢氧化钠溶液显碱性,由实验结论猜想Ⅰ成立,则取少量滤液于试管中,向其中滴加酚酞试液,酚酞试液变红色。

【题目】如表中,有关量的变化图象与其对应叙述相符的是( )
A | B | C | D |
|
|
|
|
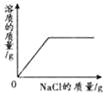
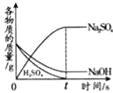
向接近饱和的NaCl溶液中加入固体NaCl | 向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2 | 向Na2CO3溶液中加入一定溶质质量分数的NaOH溶液 | 等质量、等质量分数的H2SO4溶液与NaOH溶液混合 |
A.A B.B C.C D.D