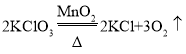题目内容
【题目】请结合下列实验常用装置,回答有关问题。
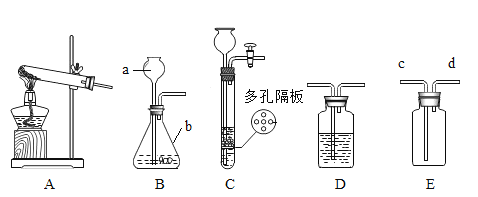
(1)写出图中标有字母的仪器的名称:a ______________,b______________。
(2)实验室用高锰酸钾制取氧气,应选用的发生装置______________,反应的化学方程式_________________。
(3)比较用过氧化氢溶液和用高锰酸钾制取O2的方法,两者的共同点是________________(填
写编号)。
A发生装置相同 B都可用MnO2作催化剂
C反应的基本类型相同 D完全反应后剩余固体成分相同
(4)实验室制取二氧化碳的反应方程式为__________。如果用E装置收集该气体,则气体从___________端进入(填“c”或“d”)。
(5)实验室常用装置C代替装置B制取气体,该装置的优点是________ ,下列反应适用于该装置的是__________(填序号) 。
①大理石和稀盐酸
②碳酸钠固体和稀硫酸
③锌粒与稀硫酸
④过氧化氢溶液与二氧化锰粉末
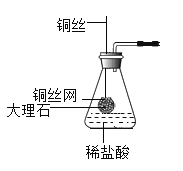
(6)有同学设计了如图所示实验室制取CO2装置,该装置是否具有C装置的作用________(填“是”或“否”)。
【答案】长颈漏斗 锥形瓶 A 2KMnO4![]() K2MnO4+MnO2+O2↑ C CaCO3+2HCl=CaCO3+H2O+CO2↑ c 可以随时控制反应的发生和停止 ①③ 是
K2MnO4+MnO2+O2↑ C CaCO3+2HCl=CaCO3+H2O+CO2↑ c 可以随时控制反应的发生和停止 ①③ 是
【解析】
(1)仪器a是长颈漏斗,仪器b是锥形瓶,故填:长颈漏斗;锥形瓶;
(2)高锰酸钾是固体,再用高锰酸钾制取氧气时需要加热,所以应该选择A装置来作为发生装置,加热高锰酸钾生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;故填:A;2KMnO4
K2MnO4+MnO2+O2↑;故填:A;2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)对比两种方法可知因为条件不同所以反应装置不同,二氧化锰第一个是催化剂,第二个是生成物,反应类型都是分解反应,生成物不相同;故填:C;
(4)实验室中制取二氧化碳的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;由于二氧化碳的密度比空气的大所以在用E装置来收集二氧化碳时应该从c管进入,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;c;
(5)将B换成C,则当需要气体时,将多孔隔板向下移入液体药品中,当不需要气体时,将多孔隔板向上移出液体药品,从而能够随时控制反应的发生和停止.选用C装置反应物必须是块状固体和液体,而碳酸钠固体是粉末,二氧化锰是粉末状;故填:可以随时控制反应的发生和停止;①③;
(6)图2中的铜丝网相当于装置C中的多孔隔板,所以该装置是否具有C装置的作用;
故填:是。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】高新一中化学兴趣小组进行硫酸亚铁铵晶体的热分解实验。小组同学称取此晶体样品39.2g,在科研人员的指导下组装出如图装置时行热分解实验。

(1)[查阅资料]
①硫酸亚铁铵晶体[Fe(NH4)x﹒(SO4)2﹒6H2O,相对分子质量为392]在100°C完全失去结晶水,剩余物在500°C完全分解为铁的某氧化物、SO2、SO3、NH3和H2O。
②B装置中浓硫酸只能吸收NH3、SO3和H2O,C装置可以吸收SO2、CO2等气体。
②碱石灰具有吸收水蒸气、二氧化碳气体的作用。
①根据资料内容,硫酸亚铁铵晶体化学式中的x=_____;
②装配好实验装置后,先要_____。
(2)[实验过程]
①实验开始时先能一-段时间N2,分别称量装置B、C的质量。
②控制不同的温度对A中固体加热,并持续通N2。
③停止加热,继续通N2直至装置冷却。
[数据分析]实验过程中测得装置B和C中的质量变化如表。
温度/°C | 室温 | 100 | 500 |
B装置/g | 200 | y | 228 |
C装置/g | 100 | 100 | 103.2 |
①表格中y=_____。
②铁的某氧化物的化学式为_____。
(3)[讨论交流]
加热前后及过程中均需通入N2,停止加热后还要继续通N2至装置冷却的目的是:可以_____和_____。
(4)[实验反思]
如果没有装置:最后盛有碱石灰的干燥管,对C装置数据可能的影响是_____(填“无法确定”、“偏大”、“不变”、“偏小”)。