题目内容
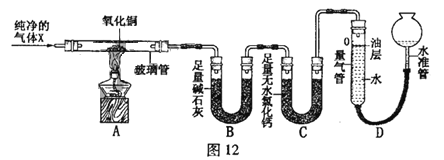
【题目】为了探究影响化学反应速率的因素,某化学兴趣小组的同学设计了如图所示的装置进行实验,收集的相关数据如下表:
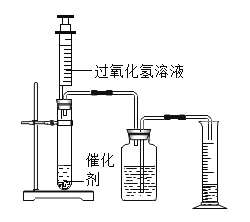
实验序号 | H2O2溶液的浓度% | H2O2溶液的体积/mL | 催化剂/g | 温度/ | 收集相同体积的O2所需的时间/s |
① | 5 | 2 | 0.1gMnO2 | 20 | 18 |
② | 10 | 2 | 0.1gMnO2 | 20 | 6 |
③ | 30 | 8 | 未加 | 40 | 64 |
④ | 30 | 8 | 未加 | 60 | 25 |
⑤ | 10 | a | 0.1gCuO | b | 16 |
(1)过氧化氢溶液与二氧化锰反应的化学方程式____。
(2)由实验_____(填实验序号)知,化学反应速率与H2O2溶液的浓度有关;由实验③和④知,化学反应速率与温度的关系是_____。
(3)表中的数据还反映出不同的催化剂对双氧水溶液分解的催化效果不同,则表中的a=___,b=____
【答案】2H2O2![]() 2H2O+ O2↑ ①② 温度越高化学反应速率越快 2 20
2H2O+ O2↑ ①② 温度越高化学反应速率越快 2 20
【解析】
(1)过氧化氢和二氧化锰混合生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+ O2↑;故填:2H2O2
2H2O+ O2↑;故填:2H2O2![]() 2H2O+ O2↑;
2H2O+ O2↑;
(2)从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系:③④则是温度不同其他条件相同,明显是对温度影响化学反应速度的探究,且温度越高化学反应速率越快;故填:①②;温度越高化学反应速率越快;
(3)探究不同的催化剂对双氧水溶液分解的催化效果不同应该是催化剂的种类不同外其他条件相同,所以表中的a=2,b= 20。故填:2;20。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】合肥郊区的农民将农作物秸秆粉碎后放在密闭的沼气池内发酵制沼气,发酵后的残余物可作肥料,沼气是一种清洁燃料,其主要成分是甲烷(CH4)。化学小组的同学围绕“秸秆主要由哪些元素组成”这一问题展开了以下探究活动。
(猜想与假设)秸秆中一定含有碳元素、氢元素和氧元素。
探究步骤 | 实验现象 | 相关结论 |
用坩埚钳夹持一小段干燥的秸秆,点燃后伸入盛有氧气的集气瓶中 | 秸秆剧烈燃烧,火焰熄灭后观察到瓶壁_____ | 产物中有H2O |
再向集气瓶中滴入少量_____ | 观察到有白色沉淀物 | 产物中有CO2 |
(结论与解释)依据化学反应前后元素的种类不变,同学们得出秸秆中含有C、H、O三种元素的结论。
(反思与评价)你认为同学们得出的结论是否正确并说明理由:__。
(拓展与应用)农村传统的处理秸秆方式是直接烧掉,试从环境、原料利用等方面说明将农作物秸秆制成沼气的重要意义是:___。写出甲烷在足量氧气中燃烧的化学方程式___。