题目内容
【题目】实验室用13.8g氯酸钾和二氧化锰的固体混合物粉末加热制取氧气,记录产生氧气的质量与加热时间的关系如图甲所示,请回答下列问题:
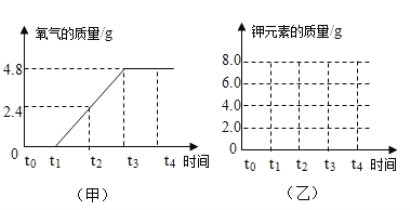
(1)t0→t1时段氧气质量为0,其原因是______________ ;t3→t4时段内剩余固体的质量为______________ ;
(2)请根据途中数据计算原混合物中氯酸钾的质量为_________。(写出计算过程,结果精确到0.1g)
(3)请在图乙坐标图中,画出固体中钾元素质量在t0→t4时段变化示意图___________。
【答案】 温度较低,未达到氯酸钾的分解速度 9.0g 12.25g 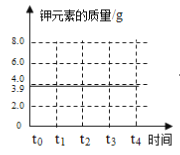
【解析】(1)根据图中信息可知:由于氯酸钾分解需要一定的温度,t0-t1固体质量不变,是因为反应还未进行;t3-t4时固体质量不变,是因为反应进行完全,剩余固体物质的质量为13.8g-4.8g=9.0g;
(2)设原混合物中氯酸钾的质量为x,
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 4.8g
![]()
x=12.25g
答:混合物中氯酸钾的质量12.25g。
(3)由质量守恒定律可知,反应前后钾元素质量不变,12.25g氯酸钾中钾元素的质量为12.25g×![]() ×100%=3.9g,所以固体中钾元素质量在t0→t4时段变化示意图为:
×100%=3.9g,所以固体中钾元素质量在t0→t4时段变化示意图为: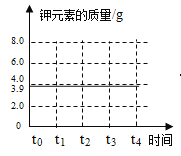 。
。

 阅读快车系列答案
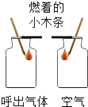
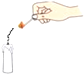
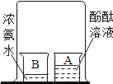
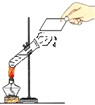
阅读快车系列答案【题目】下列实验方案与实验结论相对应的是
选项 | ① | ② | ③ | ④ |
方案 |
|
|
|
|
结论 | 比较呼出气体中CO2含量较空气中的多 | 说明白烟的成分不是二氧化碳 | 说明氨分子在不断地运动,而酚酞分子不运动 | 说明液态水与气态水可以相互转化 |
A. ①②④ B. ①④ C. ①②③④ D. ②④
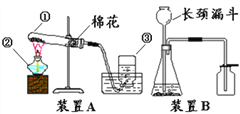
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后。某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
【猜想】Ⅰ、Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、Fe2O3参与反应产生O2,反应前后质量和化学性质发生了变化;
Ⅲ、Fe2O3是反应的催化剂,反应前后_________________ 。
【查阅资料】Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色。
【实验】用天平称量0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
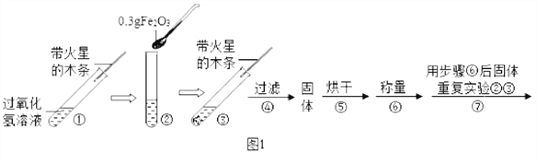
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
________________; 带火星的木条复燃。 | _________________ | 溶液中有气泡冒出, _______________。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |
(2)步骤①的目的是_____________________;
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、_______ 。
(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为____________________。
【拓展】 (1)要探究步骤⑤做过催化剂的Fe2O3其他化学性质,还应补做的实验是________。
(2)该学生为了继续探究Fe2O3 的用量对H2O2分解速率的影响,每次均用30mL10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mLO2所用的时间。结果图上图(其他实验条件相同):
由图可知,Fe2O3 的用量对H2O2分解速率影响的规律是:①___________________________ ;
②Fe2O3 的用量超过 一定范围后,其用量再增大,反应速率不再继续加快。