题目内容
【题目】图示中A一F是初中化学常见的物质,其中A是一种钠盐,C、D为氧化物,A、B、C、D、E中都含有氧元素,且物质C的固体俗称“干冰”。图中“—”表示相连的两种物质之间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物及反应条件已略去)。请分析后作答:

(1)物质A的化学式_____;物质C的用途是_____。
(2)反应①的基本反应类型是_____。
(3)反应②的化学方程式_____。
(4)写出B→D反应的化学方程式_____。
【答案】Na2CO3 灭火、人工降雨、制冷剂、气体肥料等 复分解反应 H2SO4+BaCl2=BaSO4↓+2HCl CaCO3![]() CaO+CO2↑
CaO+CO2↑
【解析】
物质C的固体俗称“干冰”,所以C为二氧化碳;A是一种钠盐,且能与其它物质反应生成二氧化碳,则A为碳酸钠;B可以由A(碳酸钠)与其它物质反应生成,且能与其它物质反应生成二氧化碳,所以B为碳酸钙;F能与B(碳酸钙)反应,则F为盐酸;D属于氧化物,能有碳酸钙与其它物质反应生成,还能与F(盐酸)反应,所以D为氧化钙;E技能与碳酸钠反应,也能与其它物质反应生成二氧化碳和盐酸,所以E为酸,则E为硫酸。
(1)由分析可知,A为碳酸钠,其化学式为Na2CO3,故填Na2CO3;
C为二氧化碳,二氧化碳可用于灭火、人工降雨、制冷剂、气体肥料等,故填灭火、人工降雨、制冷剂、气体肥料等。
(2)反应①是盐酸与氧化钙反应生成氯化钙和水,是两种化合物交换成分生成另外两种化合物,属于复分解反应,故填复分解反应。
(3)由分析可知,反应②是硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,故反应的化学方程式写为:H2SO4+BaCl2=BaSO4↓+2HCl。
(4)B→D的反应是碳酸钙在高温条件下反应生成氧化钙和二氧化碳,故反应的化学方程式写为:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。

 名校课堂系列答案
名校课堂系列答案【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
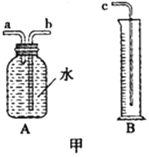
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。