题目内容
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算: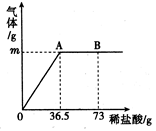
(1)A点产生气体的质量为 ;B点对应溶液中所含的溶质有 。
(2)试样中碳酸钠的质量分数(结果精确到0.1%);
(1)2.2g; NaCl和HCl; (2)88.3%
解析试题分析:(1)欲知A点产生气体的质量,须知反应物的质量和反应后的物质质量,因产生的气体全部逸出,由图象可知A点时正好完全反应,故A点时产生气体的质量为反应物的总质量减去反应后各物质的总质量:A点产生气体的质量m=6g+36.5g-40.3g=2.2g;因为到A点时已完全反应,故B点时盐酸有剩余,故B点时烧杯内溶液中的溶质是反应生成的NaCl、原有的氯化钠和和过量的盐酸;
(2)欲求试样中碳酸钠质量分数,须知碳酸钠的质量和试样的总质量;由方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑和生成的二氧化碳的质量,可求出碳酸钠的质量,则可求出6g试样中碳酸钠的质量分数。
设6g试样中Na2CO3质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g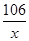 =
=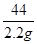
x=5.3g
试样中Na2CO3的质量分数为: ×100%=88.3%
×100%=88.3%
答:试样中Na2CO3的质量分数为88.3%
考点:根据化学反应方程式的计算

 阅读快车系列答案
阅读快车系列答案小强对当地的石灰石矿石样品进行检测,取用100g这种石灰石样品,把300g稀盐酸分3次加入,实验过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)下表中m的数值应该为 。
(2)样品中碳酸钙的物质的量是 mol。
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 100 | 60 |
| 第2次 | 100 | m |
| 第3次 | 100 | 12 |
(3)参加反应的盐酸的质量分数 (根据化学方程式列式计算)。(精确0.1%)
 Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数) 2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)
2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)