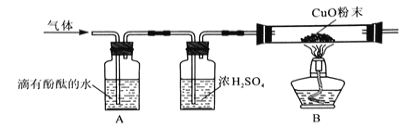
题目内容
【题目】(6分)黄铜是以Zn主要元素,添加元素铜的合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
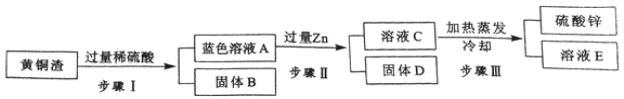
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
(1)步骤Ⅰ中产生气体的化学方程式为 。
(2)溶液A中的金属阳离子有 (填化学式)
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
【答案】(1)Zn + H2SO4 === ZnSO4 + H2↑;(2)Cu2+ 、 Zn2+ (3)过滤; 玻璃棒;(4)小于
【解析】
试题分析:(1)根据题中的叙述可知,能与稀硫酸反应的为金属锌、氧化铜、氧化锌,能产生气体的为金属锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn + H2SO4 === ZnSO4 + H2↑;(2)溶液A中的金属阳离子有Cu2+,Zn2+;(3)步骤Ⅰ、Ⅱ中均为固液分离,故包含的操作名称为过滤,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是玻璃棒;(4)溶液A小于溶液C的质量,因为溶液A中加入金属锌能置换出金属铜,金属锌的相对原子质量大于金属铜的相对原子质量。

【题目】(13分)中和反应是一类重要的反应。根据要求回答问题:
(1)许多物质在溶液中以离子形式存在。下图表示HCl、NaOH溶液及两者混合后溶质在溶液中的存在情况。
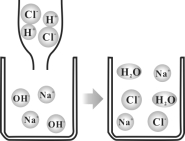
①盐酸具有酸的特性,是因为盐酸溶液中含有 (填微粒符号)。
②对比分析盐酸与氢氧化钠溶液混合前后溶液离子存在情况,可知两者反应时不会减少的离子是 。
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失。请结合上图并从微粒的角度分析,盐酸与氢氧化钠反应时,为何酸、碱各自的特性都消失?答: 。
(2)日常生活中,凡是使酸的酸性消失或碱的碱性消失的反应均被称为“中和”。如使用碳酸氢钠(其溶液显碱性)治疗胃酸(主要成分为盐酸)过多症,就因碳酸氢钠能使胃酸的酸性消失,而称为碳酸氢钠“中和”了过多的胃酸。现有碳酸氢钠溶液、酚酞溶液和盐酸溶液,设计实验证明碳酸氢钠溶液与盐酸反应时,碳酸氢钠溶液的碱性、盐酸的酸性都将各自消失。
操作 | 现象 | 结论 |
实验1:往装有碳酸氢钠溶液的试管中先加入2-3滴酚酞溶液,再逐滴加入盐酸直至恰好完全反应 | 滴入酚酞时的现象: ; 逐滴加入盐酸的现象: ________________。 | 两者反应时,碳酸氢钠溶液碱性消失 |
实验2: | 两者反应时,盐酸溶液酸性消失 |