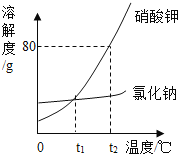
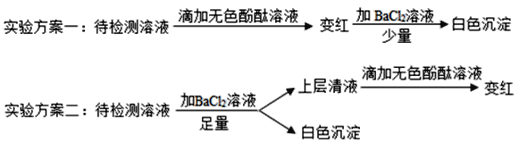
题目内容
【题目】某食用碱的主要成分是 Na2CO3,其中含有少量的 NaCl,小明同学为测定该食用碱中 Na2CO3 的质量分数,他进行了以下实验,取 40 g 食用碱,加水配成 400g 的溶液,把溶液平均分为四份,然后分别加入一定质量分数的 CaCl2 溶液,实验数据见下表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱的质量/g | 10 | 10 | 10 | 10 |
加入CaC12溶液的质量/g | 20 | 40 | 60 | 80 |
生成沉淀的质量/g | 2.5 | 5 | m | 8 |
请分析表中数据并计算回答。
(1)m=________;
(2)40 g 该食用碱配成的溶液与足量 CaCl2 溶液反应,最多生成沉淀质量为_____g;
(3)该食用碱中 Na2CO3 的质量分数是多少_____?(写出计算过程,答案精确到 0.1%)
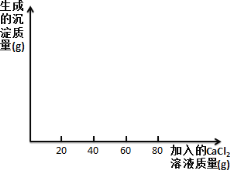
(4)请根据实验四的数据画图并标上合适的坐标数据_____。
【答案】7.5g 32 84.8% 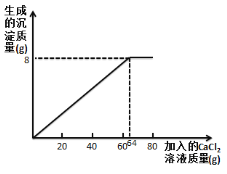
【解析】
(1)由表格数据可知,每20g CaC12溶液完全反应,产生沉淀的质量为2.5g ,则60g CaC12溶液完全反应产生沉淀的质量m=7.5g;
(2)分析表格,由实验四的数据可知,10 g该食用碱与足量 CaCl2 溶液反应,最多生成沉淀质量为8g,那么40 g该食用碱与足量 CaCl2 溶液反应,最多生成沉淀质量为![]() ;
;
(3)解:设10 g该食用碱中含Na2CO3 的质量为X。
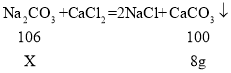
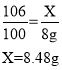
该食用碱中 Na2CO3 的质量分数为:![]() 。
。
答:该食用碱中 Na2CO3 的质量分数84.8%。
(4)根据实验四的数据可知,10 g该食用碱与足量 CaCl2 溶液反应,最多生成沉淀质量为8g,且每产生2.5g沉淀消耗氯化钙溶液的质量为20g,那么产生8g沉淀消耗氯化钙溶液的质量为64g。所以该曲线的起点坐标为(0,0),终点坐标为(64,8),如图:
 。
。

【题目】
(1)如图为“**泡打粉”标签
| (2)如图为“胃酸完全抑制剂”标签 |
①碳酸氢钠俗称____________。 ②加入泡打粉制作的蛋糕更松软,其原理可用化学方程式表示为:3NaHCO3+C6H8O7═C6H5O7Na3+3H2O+3X↑,则X的化学式为____________。 | ①氢氧化镁和胃酸发生的反应为:Mg(OH)2+2HCl═MgCl2+2H2O,该反应的基本类型是____________反应。 ②碳酸钙与胃酸反应的化学方程式为____________。 |