题目内容
【题目】水和溶液对人类的生产。生活具有重要意义。
(1)使用硬水会给生活带来许多麻烦,如_____ (写出一点即可);生活中常用煮沸的方法降低水的硬度,实验室中则用_____的方法降低水的硬度。
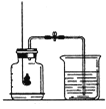
(2)水是重要的氧化物,电解水实验说明水是由_____组成,水通电分解的过程中一定不变的微粒是_____。
(3)配制溶质质量分数为3%的氯化钠溶液时,可用溶质质量分数为6%的氯化钠溶液和水配制,若量取溶质质量分数为6%的氯化钠溶液时俯视读数,其他操作均正确,则配制的溶液中溶质质量分数_____3%(填“>”、“<”、“=”)。
(4)如图为甲、乙、丙三种物质在水中的溶解度曲线。请根据图示回答:①t2℃时,向盛有50g水的烧杯中加入20g甲物质,充分溶解后,所得溶液质量为_____g,将烧杯中物质升温到t3℃时,所得溶液中溶质和溶液的质量比为_____。
②t3℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为_____;
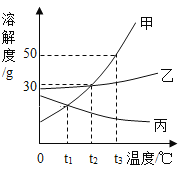
【答案】蒸汽锅炉结垢,易引发爆炸蒸馏氢、氧两种元素氢原子和氧原子 。>652:7 。丙>乙>甲 ;
【解析】
(1)生活上使用硬水,加热时就会产生大量的水垢;洗衣服时会用的洗涤剂比较多,蒸汽锅炉结垢,易引发爆炸等;软化硬水的方法很多,如药剂软化法和离子交换法等方法,生活中通过煮沸降低水的硬度。实验室常用蒸馏的方法来降低水的硬度;
(2)在电解水时,在电源的正极产生的氧气,负极产生氢气,该实验说明水是由氢、氧两种元素组成的组成的,水通电分解过程中,水分子变成了氢分子和氧分子,氢原子和氧原子没有发生变化,所以,改变的微粒是分子;不变的微粒是原子;
(3)量取溶质时是俯视读数,读数比实际液体体积大,会造成实际量取的溶液的体积偏小,则使溶质质量分数偏大;
(4)①t2℃时,甲的溶解度是30g,因此向20g甲物质中加入50g水,充分溶解后,所得溶液质量=15g+50g=65g;将其升高到t3℃时,剩余的固体全部溶解,水没有变化,因此所得溶液中溶质和溶液质量比=20g:70g=2:7;②t3℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为丙>乙>甲,因为在该温度下溶解度的大小关系是甲>乙>丙。