题目内容
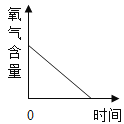
【题目】用红磷燃烧测定空气中氧气含量(装置如图)。
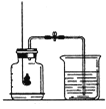
(1)红磷燃烧的化学方程式 ____________________;
(2)实验中要用过量的红磷,目的是 _________________;
(3)造成实验结果出现明显偏差的原因有 _________(填序号).
A.装置漏气 B.红磷较多 C.没有冷却就打开弹簧夹 D.燃着的红磷缓慢的伸入集气瓶
(4)由实验可得出的结论是 _____________。
(5)若将红磷换成硫粉,该实验能否获得成功?理由是 _________。
【答案】4P+5O2![]() 2P2O5 使瓶中的氧气充分被消耗ACD氧气的体积约占瓶体积的 1/5不可以,硫粉的燃烧产物为 SO2 状态为气体,会补充消耗氧气的体积,不能得出实验结论,故不可以
2P2O5 使瓶中的氧气充分被消耗ACD氧气的体积约占瓶体积的 1/5不可以,硫粉的燃烧产物为 SO2 状态为气体,会补充消耗氧气的体积,不能得出实验结论,故不可以
【解析】
(1)红磷燃烧产物是五氧化二磷,化学方程式为:4P+5O2![]() 2P2O5;
2P2O5;
(2)该实验是为了测定空气中氧气的体积分数,所以需将集气瓶内的氧气充分消耗掉,所以红磷要过量;
(3)A、如果装置漏气,能够导致进入集气瓶中的水不到集气瓶容积的五分之一;B、红磷不足,能够导致进入集气瓶中的水不到集气瓶容积的五分之一,若红磷较多,可以把氧气完全消耗,结果更准确;C、没有冷却至室温就打开弹簧夹,能够导致进入集气瓶中的水不到集气瓶容积的五分之一;D、如果实验过程中,燃烧匙伸入集气瓶中时太慢,会导致集气瓶中的空气受热膨胀外逸,从而导致测定的结果偏大;
(4)做完整个实验可得出的结论是氧气约占空气体积的五分之一;
(5)若将红磷换成硫粉,该实验不能否获得成功,理由是:硫燃烧生成物是气体,瓶内压强不变小。

练习册系列答案
相关题目