题目内容
【题目】金属材料的生产和使用是人类社会文明和进步的重要标志。
(1)下列生活用品,主要是由金属材料制成的是________

(2)制造汽车要用到含铜、铁、铝等成分的多种金属材料。
①在汽车电路中,经常用铜作导线,这是利用了铜的________性。
②车体多用钢材制造,其表面喷漆不仅美观,而且可有效防止与________接触而生锈。
③下列物质不属于合金的是________(填序号)
A.青铜 B.硬铝 C.生铁 D.水银
(3)图是某兴趣小组改进的一氧化碳还原氧化铁的实验装置。
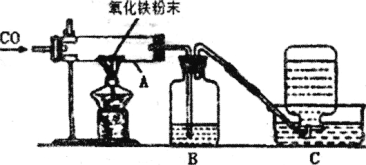
①由B装置中产生的现象明判断反应是否开始发生。则B中的试剂是________(填名称).
②为检验反应后有铁生成,进行如下实验:取反应后的少量固体放入稀硫酸中,观察到有气泡冒出,写出该反应的化学方程式________。
③C装置的作用是________。
(4)向硫酸铜和硫酸亚铁的混合溶液中加入一些镁粉,充分反应后过滤,得到固体和滤液。将过滤得到的固体放入稀硫酸中有气体产生,则固体中一定含有________,滤液中(水除外)一定不含有________。
【答案】AC导电空气和水D石灰水Fe+H2SO4=FeSO4+H2↑收集多余的一氧化碳气体,防止污染空气。Fe Cu或(铁铜);CuSO4(或硫酸铜)
【解析】
(1)铁锅和硬币主要由金属材料制成;
(2)①铜用作导线,是因为铜具有良好的导电性;
②铁在与氧气和水蒸气同时接触时会生锈,在车体表面喷漆可以防止铁与氧气、水蒸气接触而生锈;
③A、青铜是铜锡合金;B、硬铝是铝合金;C、生铁是铁碳合金;D水银是纯净物;
(3)①如果一氧化碳和氧化铁开始反应,生成的二氧化碳进入B中,如果B是石灰水,则石灰水变浑浊,可以用石灰水判断反应是否开始;
②铁能与盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑;
③通过C装置可以把一氧化碳收集起来,避免扩散到空气中污染环境,C装置收集的方法是排水法;
(4)根据金属活动顺序表知镁比铁活泼,铁比铜活泼,所以加入镁粉,首先镁粉和硫酸铜溶液反应,置换出单质铜,如果镁粉足量可以再继续和硫酸亚铁反应置换出铁,向滤出的固体中滴加稀硫酸,有少量气泡产生,说明固体中含有和稀硫酸反应的金属,所以能把铜离子全置换出来,如果镁粉足量,能把溶液中的铜离子、亚铁离子全置换出来,则固体中一定含有铜和铁,滤液中(水除外)一定不含有硫酸铜。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案