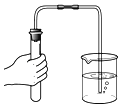
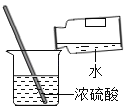
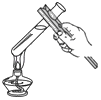
题目内容
【题目】用高锰酸钾制取氧气,固体的质量变化情况如图所示,下列分析不正确的是( )
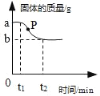
A. a 与 b 质量差是生成氧气的质量
B. P 点处固体成分是锰酸钾和二氧化锰
C. 反应前高锰酸钾的质量为![]()
D. 反应过程中,锰元素在固体中的质量保持不变
【答案】B
【解析】
A.高锰酸钾在加热条件下分解生成氧气、锰酸钾、二氧化锰,据质量守恒定律可知,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以反应前后固体质量的差即为生成氧气的质量,选项正确;
B. P点处高锰酸钾没有完全分解,固体成分是锰酸钾和二氧化锰、剩余的高锰酸钾,选项错误;
C. 设反应前高锰酸钾的质量为x

![]() x=
x= ![]() ,选项正确;
,选项正确;
D. 据质量守恒定律可知反应前后元素的种类、质量不变,反应过程中,锰元素在固体中的质量保持不变,选项正确。故选B。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
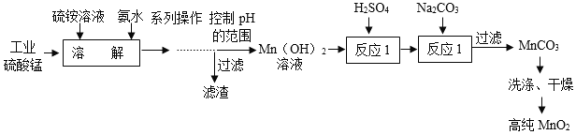
金状元绩优好卷系列答案【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?
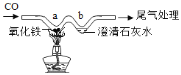
【题目】云通过探究发现,氯酸钾与氧化铜(CuO)、氧化铁(Fe2O3)混合加热,也能较快产生氧气,于是进行如下探究:
(查阅资料)氯酸钾的熔点为356℃,常温下稳定,在400℃以上则分解产生氧气。酒精灯加热温度为400℃~500℃。
(提出猜想)除MnO2、CuO外,Fe2O3也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验并测定分解温度。
实验编号 | 实验药品 | 分解温度 |
1 | 3.0g氯酸钾 | 460℃ |
2 | 3.0g氯酸钾和0.5g二氧化锰 | 248℃ |
3 | 3.0g氯酸钾和0.5g氧化铜 | 267℃ |
4 | 3.0g氯酸钾和Xg氧化铁 | 290℃ |
(分析数据,得出结论)
(1)实验3的化学反应式:______________________。
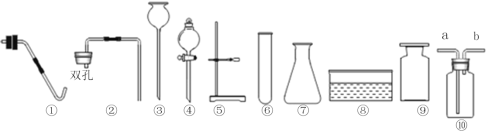
(2)小云从下图中选择该实验的最佳发生装置是__________。
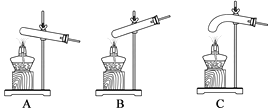
(3)实验4中X的值应为__________,由实验__________与实验4对比,证明猜想合理。
(4)通过实验测得的数据,小云绘出了部分下图,请帮他完成该图。
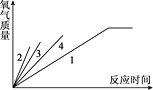
(结论)通过该实验探究中,得到的结论有__________(填序号)。
A.催化剂可降低反应温度
B.二氧化锰只能催化氯酸钾的分解
C.催化剂的质量和性质在反应前后不变
D.催化剂可改变产物的质量
E.三种催化剂中,二氧化锰对氯酸钾分解催化效果最好