题目内容
【题目】高纯碳酸锰(MnCO3)有广泛的用途,采用工业硫酸锰制备流程如下:
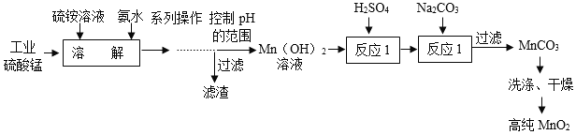
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。
(1)系列操作后“控制pH的范围_____(填>、<、=)7.7。
(2)反应1属于基本反应类型中的_____(填“置换反应”“中和反应”“复分解反应”)。
(3)写出反应2的化学方程式_____,洗涤剂最好选择乙醇的原因_____,烘干在_____(填>、<、等于=)100°C的真空中进行。
【答案】< 复分解反应 MnSO4+Na2CO3=Na2SO4+MnCO3↓ 洗去表面的杂质,便于快速干燥,且能防止氧化而变质 <
【解析】
(1)Mn(OH)2开始沉淀的pH=7.7,所以系列操作后控制pH<7.7,防止生成Mn(OH)2沉淀。
(2)反应1为氢氧化锰和稀硫酸反应生成硫酸锰和水,该反应属于复分解反应,也属于中和反应,但中和反应不是基本反应类型。
(3)反应2为硫酸锰和碳酸钠反应生成碳酸锰沉淀和硫酸钠,反应的方程式为:MnSO4+Na2CO3=Na2SO4+MnCO3↓。洗涤剂选用乙醇的原因为:MnCO3难溶于乙醇,乙醇可以洗去表面的杂质,易挥发便于快速干燥,且能防止氧化。MnCO3潮湿时易被空气氧化,100℃开始分解,故烘干在<100°C的真空中进行。

【题目】在20℃环境中,制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如下探究实验。
(查阅资料)(1)碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
(2)20℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 110 | 21.8 | 9.6 |
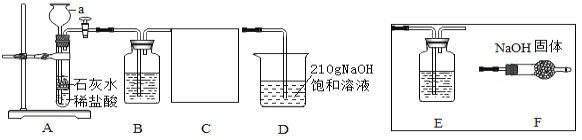
(定性探究)(1)仪器a的名称是____________________;
(2)装置B中盛有 NaHCO3溶液,目的是吸收装置A中挥发出的HCl气体,写出B中发生反应的化学方程式:_______________;
(3)装置C的作用是______________,选择________(选填E、F)达到实验目的;
(4)在实验过程中装置D中观察到______________,说明CO2和NaOH溶液能发生反应。
(定量计算)
(5)装置D中NaOH全部转化成Na2CO3时,理论上最多可以生成Na2CO3多少克____________?
(6)当向装置D中通入足量的CO2时,可以将NaOH全部转化为NaHCO3,实验过程中会析出的NaHCO3质量___________g(不考虑结晶水)。