题目内容
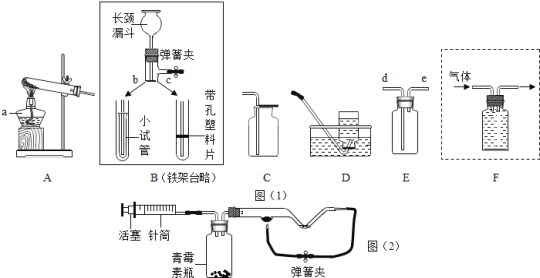
【题目】实验室制取气体所需的装置如下图所示,请回答下列问题:
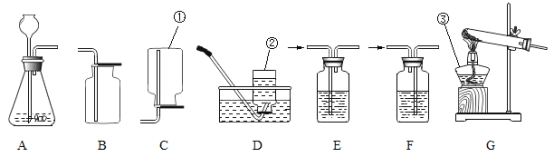
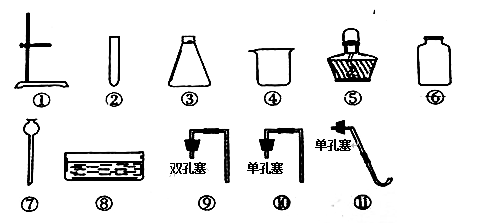
(1)写出装置中有标号的仪器名称:②_________;③________
(2)实验室制取氧气和二氧化碳都可以选用的制取装置为________(填字母序号);收集到的二氧化碳气体如何检验(用化学方程式表示)_________________;在加入药品之前应对实验装置进行 ___________;若用E装置收集氧气,当观察至导管口有气泡____________地放出时,即可进行收集。
【答案】集气瓶 酒精灯 A ![]() 气密性检测 连续均匀
气密性检测 连续均匀
【解析】
根据实验室制取氧气和二氧化碳制取装置、反应方程式及收集装置等进行分析解答。
(1)据图可知,②仪器是集气瓶;③是酒精灯。故填:集气瓶;酒精灯。
(2)实验室制取氧气可用过氧化氢分解制取氧气,常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,都属于固液常温型,可选择装置A作为发生装置;二氧化碳能使澄清的石灰水变浑浊,所以可用澄清的石灰水来检验二氧化碳气体,可向该集气瓶中加入澄清石灰水,振荡后,观察到溶液变浑浊,发生反应的化学方程式为![]() ;在加入药品之前应对实验装置进行气密性检测;若用E装置收集氧气,当观察至导管口有气泡连续均匀地放出时,即可进行收集。
;在加入药品之前应对实验装置进行气密性检测;若用E装置收集氧气,当观察至导管口有气泡连续均匀地放出时,即可进行收集。
故填: A;![]() ;气密性检测;连续均匀。
;气密性检测;连续均匀。

 阅读快车系列答案
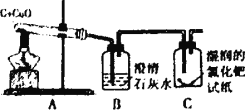
阅读快车系列答案【题目】研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
假设:过氧化氢生成氧气的快慢与催化剂种类有关
实验方案:常温下,在两瓶相同体积的过氧化氢溶液中分别加入相同质量二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
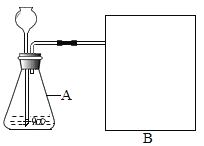
进行实验:如图是他们进行实验的装置,此实验中B处最宜采用的气体收集方法是:_______。
实验记录:
实验编号 | 1 | 2 |
反应物 | 6% 过氧化氢溶液 | 6%过氧化氢溶液 |
催化剂 | 1g红砖粉 | 1g 二氧化锰 |
时间 | 152s | 35s |
结论:该探究过程得出的结论是______________。
反思:过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰或红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的__________和_______是否改变。