题目内容
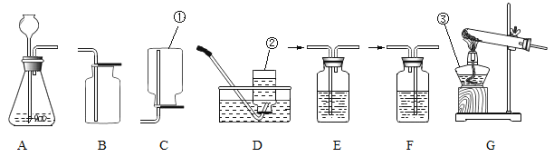
【题目】粗盐中常含有MgCl2、CaCl2等杂质,提纯精盐的工艺流程如图所示。(提示:微溶物不形成沉淀)
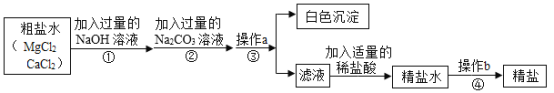
(1)写出白色沉淀的化学式:_____。
(2)步骤②加入过量Na2CO3溶液的目的是什么?_____
(3)步骤⑤中,要用玻璃棒不断搅拌,其目的是什么?_____
【答案】Mg(OH)2和CaCO3 完全除去粗盐中的CaCl2杂质 防止局部温度过高,使液滴飞溅(或使受热均匀)
【解析】
(1)氢氧化钠能与氯化镁溶液反应生成氢氧化镁沉淀,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,则白色沉淀为氢氧化镁和碳碳酸钙,其化学式分别是Mg(OH)2、CaCO3。
(2)钙离子可用碳酸根离子来除去,氯化钙能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,步骤②加入过量的碳酸钠溶液的作用是完全除去氯化钙。
(3)步骤⑤是蒸发操作,要用玻璃棒不断搅拌,其目的是防止局部温度过高,造成液体飞溅。
故答案为:
(1)Mg(OH)2、CaCO3;
(2)完全除去氯化钙;
(3)防止局部温度过高,造成液体飞溅。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目