题目内容
【题目】我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了突出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠,现取24g该纯碱样品,加入100g水使其完全溶解,再加入158g氯化钙溶液,恰好完全反应后,过滤后得滤液262g(忽略实验过程中质量的损耗)。计算:
(1)纯碱样品中碳酸钠的质量;
(2)反应后所得溶液中溶质的质量分数为多少?(结果精确到0.1%)
【答案】(1)21.2 g (2)10.0%
【解析】
根据质量守恒定律,反应前所有物质的总量减去最后滤液的质量即为碳酸钙的质量: ![]() ,然后代入方程式,并用溶质质量分数公式进行解答。
,然后代入方程式,并用溶质质量分数公式进行解答。
(1)碳酸钙质量为![]()
(2)设样品中碳酸钠的质量为![]() ,生成氯化钠的质量为
,生成氯化钠的质量为![]() 。
。
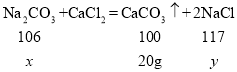
![]() ,解得
,解得![]() =21.2 g
=21.2 g
![]() ,解得
,解得![]() = 23.4 g
= 23.4 g
原样品中氯化钠的质量:![]()
反应后溶液中溶质的质量分数为:![]()
答:纯碱样品中碳酸钠的质量为21.2 g;反应后所得溶液中溶质的质量分数为10.0%。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】敞口放置于空气中的氢氧化钠溶液能够发生下列变化而变质:

上述反应①的化学方程式为_____________, NaHCO3俗称______。某校化学学习小组师生对一瓶氢氧化钠溶液的变质情况进行了如下探究:
(提出问题)NaOH是否变质?
(做出猜想)
猜想1:NaOH全部变质。
猜想2:_____
(制定计划)老师探究是否产生了NaHCO3,学生在老师探究的基础上进一步探究。
(进行试验)
试验操作 | 试验现象 | 试验分析 | |
老师试验 | 略 | 略 | 没有产生NaHCO3 |
学生试验 | a,取一定量的待测液于试管中,加入足量CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式为______ |
b,充分反应后静置,取上层清液加入无色酚酞溶液 | 溶液变红 | 原待测液中含有______ |
(表达交流)有同学认为上述实验a中的CaCl2溶液可改为澄清石灰水,你是否同意这种看法?_____(填“同意”或“不同意”)。
(实验结论)上述猜想2成立。
(反思评价)在实验室中,氢氧化钠应密封保存。