题目内容
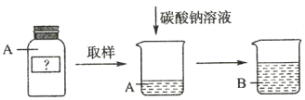
【题目】有一包白色粉末可能由氯化钠、硫酸钠、硫酸铜、碳酸钠、碳酸钙中的一种或几种组成,为确定其组成,进行如下实验:
①称取一定质量的该白色粉末加足量水溶解,得无色溶液![]() ;
;
②在无色溶液![]() 中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液
中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液![]() 和白色沉淀
和白色沉淀![]() ;将白色沉淀
;将白色沉淀![]() 洗涤,烘干后称得质量为
洗涤,烘干后称得质量为![]() ;
;
③在![]() 白色沉淀
白色沉淀![]() 中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出;
中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出;
④在无色溶液![]() 中滴加硝酸银溶液和稀硝酸,产生白色沉淀。
中滴加硝酸银溶液和稀硝酸,产生白色沉淀。
根据上述实验现象判断,下列说法不正确的是
A.白色粉末中可能含有氯化钠B.无色溶液![]() 中含有两种溶质
中含有两种溶质
C.白色粉末中不含碳酸钙、硫酸钠、硫酸铜D.步骤③生成的气体质量可能是![]()
【答案】CD
【解析】
本题考查混合物成分的检验。称取一定质量的该白色粉末加足量水溶解,得无色溶液![]() ,所以白色粉末中一定不含碳酸钙、硫酸铜;在无色溶液
,所以白色粉末中一定不含碳酸钙、硫酸铜;在无色溶液![]() 中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液
中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液![]() 和白色沉淀
和白色沉淀![]() ;向白色沉淀
;向白色沉淀![]() 中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出,说明白色沉淀
中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出,说明白色沉淀![]() 是硫酸钡沉淀和碳酸钡沉淀的混合物,所以白色粉末中一定含有碳酸钠、硫酸钠;所以
是硫酸钡沉淀和碳酸钡沉淀的混合物,所以白色粉末中一定含有碳酸钠、硫酸钠;所以![]() 中的溶质是氯化钠和氯化钡,在无色溶液
中的溶质是氯化钠和氯化钡,在无色溶液![]() 中滴加硝酸银溶液和稀硝酸,产生白色沉淀,说明溶液
中滴加硝酸银溶液和稀硝酸,产生白色沉淀,说明溶液![]() 中含有氯离子,但是加入的氯化钡引入了氯离子,所以原固体粉末中氯化钠不一定存在。通过化学方程式
中含有氯离子,但是加入的氯化钡引入了氯离子,所以原固体粉末中氯化钠不一定存在。通过化学方程式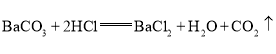 ,可以看出,碳酸钡和二氧化碳的质量关系197:44,所以生成
,可以看出,碳酸钡和二氧化碳的质量关系197:44,所以生成![]() 的二氧化碳,需要碳酸钡
的二氧化碳,需要碳酸钡![]() ,超过了沉淀的总质量。故选CD。
,超过了沉淀的总质量。故选CD。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目