题目内容
“用H2O2和MnO2制氧气”的反应方程式为:
小华同学做了该实验后,展开了下列思考与探究:
问题一:催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?答:
问题二:H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?答:
由表中数据还可看出,该反应是个
问题三:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
启发:在探究问题一和问题二的实验中,小华采用了控制变量的实验方法,从而轻松的解决了多种因素影响反应速度的问题.你认为在探究问题一时,小华控制的变量是
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
小华同学做了该实验后,展开了下列思考与探究:
问题一:催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
有影响;在一定范围内,MnO2的用量越大,反应越快
有影响;在一定范围内,MnO2的用量越大,反应越快
.问题二:H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集540mL气体所用时间(t) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
有影响.H2O2溶液的溶质质量分数越大,反应越快
有影响.H2O2溶液的溶质质量分数越大,反应越快
.由表中数据还可看出,该反应是个
放热
放热
反应(填“放热”或“吸热”).问题三:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
MnO2颗粒大小、环境温度、气压、是否振荡等
MnO2颗粒大小、环境温度、气压、是否振荡等
.启发:在探究问题一和问题二的实验中,小华采用了控制变量的实验方法,从而轻松的解决了多种因素影响反应速度的问题.你认为在探究问题一时,小华控制的变量是
H2O2溶液的溶质质量分数;MnO2颗粒大小;环境温度;外界气压;振荡
H2O2溶液的溶质质量分数;MnO2颗粒大小;环境温度;外界气压;振荡
(至少写出一个,多写一个加1分,最多加2分.).分析:根据过氧化氢在二氧化锰的作用下产生水和氧气写出反应的方程式;
问题一:由题目中提供的信息每次实验过氧化氢的量相同,二氧化锰的量不同,制取的氧气量相同,所用时间不同,可以看出二氧化锰的用量对反应速度的影响;
问题二:其它条件相同,过氧化氢的浓度不同,生成相同氧气的时间不同,可以看出过氧化氢溶液的质量分数对反应速度的影响;通过温度的变化可以看出反应伴随的能量变化;
问题三:可能影响该反应的速率的因素:二氧化锰颗粒大小、环境温度等..
问题一:由题目中提供的信息每次实验过氧化氢的量相同,二氧化锰的量不同,制取的氧气量相同,所用时间不同,可以看出二氧化锰的用量对反应速度的影响;
问题二:其它条件相同,过氧化氢的浓度不同,生成相同氧气的时间不同,可以看出过氧化氢溶液的质量分数对反应速度的影响;通过温度的变化可以看出反应伴随的能量变化;
问题三:可能影响该反应的速率的因素:二氧化锰颗粒大小、环境温度等..
解答:解:过氧化氢在二氧化锰的作用下产生水和氧气,反应的方程式为;2H2O2
2H2O+O2↑;
问题一:分析表中数据可知:MnO2的用量对反应速率有影响,在一定范围内,二氧化锰的用量越大,反应越快;
问题二:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响:每次用等量的二氧化锰,采用足量不同浓度的过氧化氢溶液进行实验,观察收集等量气体时所消耗的时间可知:H2O2溶液的溶质质量分数越大,反应越快;由表中数据还可看出,该反应是个放热反应;
问题三:可能影响该反应的速率的因素:二氧化锰颗粒大小、环境温度、是否振荡等;
启发:要探究二氧化锰对过氧化氢的分解速率,应该控制H2O2溶液的溶质质量分数;MnO2颗粒大小;环境温度;外界气压;振荡等因素,看二氧化锰的用量对过氧化氢的催化效果.
故答案为:2H2O2
2H2O+O2↑;
问题一:有影响;在一定范围内,MnO2的用量越大,反应越快(注意:“一定范围”这个关键词);
问题二:有影响.H2O2溶液的溶质质量分数越大,反应越快(“质量分数”是要点);放热;
问题三:MnO2颗粒大小、环境温度、是否振荡等;(“颗粒大小、环境温度、是否振荡”只要答出其中一点即可;其它合理答案也可)
启发:H2O2溶液的溶质质量分数;MnO2颗粒大小;环境温度;外界气压;振荡.(其它合理答案也可)
| ||
问题一:分析表中数据可知:MnO2的用量对反应速率有影响,在一定范围内,二氧化锰的用量越大,反应越快;
问题二:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响:每次用等量的二氧化锰,采用足量不同浓度的过氧化氢溶液进行实验,观察收集等量气体时所消耗的时间可知:H2O2溶液的溶质质量分数越大,反应越快;由表中数据还可看出,该反应是个放热反应;
问题三:可能影响该反应的速率的因素:二氧化锰颗粒大小、环境温度、是否振荡等;
启发:要探究二氧化锰对过氧化氢的分解速率,应该控制H2O2溶液的溶质质量分数;MnO2颗粒大小;环境温度;外界气压;振荡等因素,看二氧化锰的用量对过氧化氢的催化效果.
故答案为:2H2O2
| ||
问题一:有影响;在一定范围内,MnO2的用量越大,反应越快(注意:“一定范围”这个关键词);
问题二:有影响.H2O2溶液的溶质质量分数越大,反应越快(“质量分数”是要点);放热;
问题三:MnO2颗粒大小、环境温度、是否振荡等;(“颗粒大小、环境温度、是否振荡”只要答出其中一点即可;其它合理答案也可)
启发:H2O2溶液的溶质质量分数;MnO2颗粒大小;环境温度;外界气压;振荡.(其它合理答案也可)
点评:本题通过实验探究的方式探究了影响化学反应速度影响的因素,利用控制变量的方法进行实验探究,培养了学生分析问题解决问题的能力,认识了对化学反应速度影响的因素.

练习册系列答案
相关题目
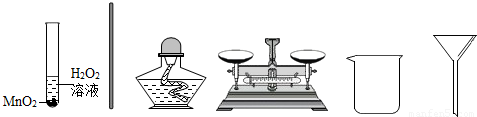
科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.在四支试管中分别加入0.2克二氧化锰(MnO2)粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生的速度,记录如下:
(1)用H2O2和MnO2制氧气中,MnO2的作用是 用H2O2和MnO2制氧气的基本反应类型是 反应.
(2)该实验研究的问题是:过氧化氢分解的速率与 有关系,能得出的结论是 .
(3)实验完毕,可利用过滤法回收剩余溶液中的二氧化锰粉末.在过滤过程中,下列仪器不需要的有 .(填下列仪器名称)
| 实验次数 | 1 | 2 | 3 | 4 |
| H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
| MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
| 气泡产生的速率 | + | ++ | +++ | ++++ |
(2)该实验研究的问题是:过氧化氢分解的速率与 有关系,能得出的结论是 .
(3)实验完毕,可利用过滤法回收剩余溶液中的二氧化锰粉末.在过滤过程中,下列仪器不需要的有 .(填下列仪器名称)